Вступ
Хвороба Паркінсона (ХП) є досить поширеною ней-родегенеративною патологією центральної нервової системи (ЦНС), яка має тенденцію до неухильного зростання й призводить до інвалідизації пацієнтів [1, 2]. Виявлення цього захворювання переважно в людей, старших за 60 років, вказує на його зв’язок з віком. Порушення функціонування ЦНС при ХП характеризуються руховими, емоційними, вегетативними й когнітивними проявами. Доведено, що в розвитку морфофункціональних порушень при ХП/паркінсонізмі велику роль відіграють фактори оксидативного стресу й продукти клітин активованої мікроглії/макрофагів [3, 4].
На сьогодні використання медикаментозних засобів є основним методом лікування пацієнтів із ХП. Проте серед нових перспективних підходів до терапії ХП/паркінсонізму заслуговує на увагу трансплантація мультипотентних мезенхімальних стромальних клітин (ММСК) різного тканинного походження (жирова тканина (ЖТ), кістковий мозок, пуповина тощо) [5]. Показано, що ММСК здатні до мультилінійного диференціювання, синтезу й секреції нейротрофічних факторів, трофічного впливу на ушкоджені органи й тканини, а також виявляють імуномодулюючі, антизапальні й антиоксидантні властивості [6–9]. Особливу увагу дослідників і клініцистів привертають ММСК із жирової тканини як одного із найбільш доступних і безпечних джерел.
Разом з тим автори пов’язують випадки недостатньої ефективності трансплантованих ММСК-ЖТ при патології ЦНС із віком донорів цих клітин [10]. Так, встановлено, що при старінні знижується проліферативний, диференціювальний потенціал ММСК, синтез ними ростових, трофічних факторів і протизапальних цитокінів [11]. Проте вікові аспекти регенераторного впливу ММСК-ЖТ при паркінсонізмі залишаються недостатньо вивченими.
Існують підходи/засоби впливу як на біологічні властивості ММСК, так і на виживаність цих клітин після трансплантації в організми з різними патологічними станами. Зокрема, показано, що гормон мелатонін in vivo змінює проліферацію, міграцію і диференціювання ММСК, сприяє виживанню останніх після трансплантації, а також виявляє антизапальні, антиоксидантні, імуномодулюючі властивості [12, 13]. Важливо, що з віком синтез мелатоніну пінеальною залозою зменшується, тоді як екзогенний мелатонін чинить нейропротекторний, антиоксидантний, антизапальний ефект у старіючих тварин з експериментально індукованим паркінсонізмом [14, 15].
Мета — дослідити й порівняти вплив ММСК-ЖТ мишей різного віку на показники поведінки, оксидативного стресу й число макрофагів у головному мозку старіючих мишей з експериментальною моделлю паркінсонізму; оцінити зміни ефектів клітин від донорів старшого віку під впливом гормону мелатоніну.
Матеріали та методи
Тварини. Досліди проводили на 65 мишах-самицях лінії 129/Sv (гаплотип H-2b) вікових груп 5–6 міс. (дорослі) і 15–17 міс. (старіючі) із розплідника ДУ «Інститут генетичної та регенеративної медицини НАМН України». Миші знаходились у стандартних умовах віварію при фіксованому світловому режимі 12 : 12 і вільному доступі до їжі й води ad libitum. Біологічний матеріал для дослідів отримували за допомогою декапітації мишей під ефірним наркозом у ранкові години доби. Усі експериментальні роботи виконували з дотриманням Закону України «Про захист тварин від жорстокого поводження», Європейської конвенції щодо захисту хребетних тварин, які використовуються з експериментальною та іншою науковою метою (Страсбург, 1986).
Експериментальні моделі. Для відтворення моделі паркінсонізму використовували нейротоксин 1-метил-4-феніл-1,2,3,6-тетрагідропіридин (МФТП), який після системного введення мишам ушкоджує дофамінергічні нейрони чорної субстанції середнього мозку й призводить до моторних порушень, схожих на симптоми ХП у людини [16]. В експерименті МФТП (Sigma, США) вводили старіючим мишам лінії 129/Sv підшкірно (у ділянку шиї) одноразово в дозі 30 мг/кг (розчинник нейротоксину — 0,9% розчин хлориду натрію). Нами раніше встановлено, що МФТП у такий дозі через 17 діб після введення призводить до значного ушкодження дофамінергічних нейронів чорної субстанції мишей цієї лінії і віку [15, 17].
Виділення і культивування ММСК-ЖТ. Виділення, культивування й спрямоване диференціювання ММСК-ЖТ здійснювали за стандартними протоколами, як нами описано в попередніх дослідженнях [18]. ММСК із підшкірної ЖТ дорослих (ММСК-ЖТ1) і старіючих (ММСК-ЖТ2) мишей отримували за допомогою подрібнення їх ЖТ в 0,1% розчині колагенази 1А. Отриману суміш ресуспендували, центрифугували, відбирали надосадову рідину, а утворений осад ресуспендували в поживному середовищі й переносили в культуральні флакони. Культивування проводили в поживному середовищі, яке містило 10 % ембріональної телячої сироватки, 2 mM L-глутаміну, 100 Мод/мл пеніциліну, 100 мкг/мл стрептоміцину, при температурі +37 °С і 5% вмісті СО2.
Для введення експериментальним тваринам використовували ММСК-ЖТ 2-го пасажу. Приналежність цих клітин до ММСК було визначена за відповідним імунофенотипом, а також здатністю диференціюватися в остеогеному й адипогеному напрямках, що відповідає мінімальним критеріям ММСК. Клітини культури ЖТ 2-го пасажу експресували на поверхні маркерні антигени СD44, СD73, Sca-1 і СD90, але при цьому не експресували СD45 і СD34 [18]. Фенотипування культур клітин проводили з використанням моноклональних антитіл (МАТ) до мембранних антигенів миші, кон’югованих з флуорохромами, у робочій концентрації 0,5 мкг/мл (Becton Diskinson, США), на сортері BD FACSAria (Becton Diskinson, США).
ММСК-ЖТ1 або ММСК-ЖТ2 2-го пасажу вводили у хвостову вену мишей одноразово в дозі 7 × 105 клітин у 50 мкл 0,9% хлориду натрію, через 17 діб після одноразової ін’єкції МФТП. Як вже зазначено [17], у мишей в цей період розвиваються значні морфофункціональні зміни ЦНС. Контроль — одна ін’єкція 0,9% розчину хлориду натрію у хвостову вену мишей з моделлю паркінсонізму.
Мелатонін (Sigma, США) вводили мишам із моделлю паркінсонізму внутрішньоочеревинно, щоденно о 18:00 із розрахунку 1 мг/кг, починаючи з наступної доби після ін’єкції ММСК-ЖТ2 (усього 13–14 ін’єкцій).
Експериментальні групи старіючих мишей. 1 — інтактна група; 2 — миші, яким вводили МФТП і 0,9% розчин хлориду натрію (контрольна група); 3 — миші, яким вводили МФТП і ММСК-ЖТ1; 4 — миші, які отримували ін’єкції МФТП і ММСК-ЖТ2; 5 — миші, які отримували ін’єкції МФТП, ММСК-ЖТ2 і мелатонін. Дослідження у тварин з моделлю паркінсонізму, які отримували лише екзогенний мелатонін, проведені нами раніше [15]. У кожній експериментальній групі було по 10 особин. Дослідження в усіх експериментальних групах мишей проводили в терміни, що відповідають трьом тижням після трансплантації ММСК-ЖТ.
Функціональний стан ЦНС вивчали за показниками поведінки в тестах «відкрите поле», на ригідність і в ротарод-тесті, як нами було описано раніше [15, 17]. У тесті «відкрите поле» оцінювали горизонтальну рухову, вертикальну рухову, емоційну й орієнтовно-дослідницьку активності. Мишей усіх груп тестували впродовж 3 хв. Ротарод-тест (тест із барабаном, що обертається) дає змогу досліджувати координацію, рівновагу і м’язовий тонус мишей. Результати наводили у вигляді сумарного часу (секунда) утримання на валу при 10 і 20 об/хв. Ригідність у тварин оцінювали за змінами довжини тіла (міліметри) і ходи. Для оцінки ходи стопи тварин обробляли нетоксичними розчинами фарб різного кольору і за відбитками вимірювали довжину кроку, довжину і ширину стопи (міліметри). Довжина кроку є одним з показників зміни ходи тварин, і її зменшення свідчить про порушення м’язової функції.
Фенотипування клітин головного мозку за маркерами CD3, CD11b проводили з використанням МАТ до мембранних антигенів миші, мічених флюорохромами, у робочій концентрації 0,5 мкг/мл (Becton Dickinson, США). У полістирольні пробірки об’ємом 5 мл вносили 1 × 106 клітин гомогенату головного мозку в 50 мкл буфера для фарбування (фосфатний буфер, який містить 0,1 % азиду натрію і 1 % СЕК) і додавали МАТ (розведення 1 : 50). Проводили інкубацію протягом 20 хв при температурі 4 °С, після чого відмивали в буфері для відмивки CellWash, центрифугували при 200 g протягом 5 хв з підтриманням температури 4 °С. Безпосередньо перед аналізом суспензію пропускали через клітинні фільтри з діаметром пор 70 мкм. Вимірювання проводили на лазерному проточному цитофлюориметрі-сортері BD FACSAria (Becton Dickinson, США) за допомогою програми BD FACS Diva 6.1.
Оцінку показників оксидативного стресу й антиоксидантного захисту головного мозку проводили за методами, описаними нами раніше [15, 17]. Уміст малонового діальдегіду (MДA) визначали в гомогенатах головного мозку за інтенсивністю забарвлення триметинового комплексу, що утворюється у процесі реакції між MДA і тіобарбітуровою кислотою і має характерний спектр поглинання з максимумом при довжині хвилі 535 нм.
Активність антиоксидантних ферментів досліджували в супернатантах гомогенатів головного мозку спектрофотометричним методом (спектрофотометр μQuant, Bio-Tek, США). Активність супероксиддисмутази (СОД) оцінювали в умовних одиницях за її здатністю пригнічувати реакцію автоокиснення адреналіну в адренохром при рН 10,2 із розрахунку на 1 мг білка за 1 хв. Активність каталази визначали з кінетики руйнування Н2О2 і виражали в мікромолях утилізованої Н2О2 на 1 мг білка за 1 хв. Активність глутатіонпероксидази (ГП) і глутатіонредуктази (ГР) вимірювали за зменшенням NADPH у сполученій глутатіонредуктазній реакції з додаванням у реактивну суміш відповідних реагентів і виражали в наномолях окисненого NADPH на 1 мг білка за 1 хв. Уміст білка в головному мозку вимірювали за методом Лоурі. Усі реагенти — Riedel-deHaën, Fluka, Німеччина.
Статистичний аналіз результатів проводили за допомогою t-критерію Стьюдента (M ± m). Різницю між досліджуваними показниками вважали вірогідною при значенні P < 0,05. Для статистичного аналізу отриманих результатів використовували програму Statistica 7.0 (StatSoft Inc., США).
Результати
Вплив ММСК-ЖТ дорослих і старіючих мишей-донорів або останніх у комбінації з мелатоніном на поведінку мишей з моделлю паркінсонізму. Встановлено, що в мишей під впливом МФТП число пересічених квадратів, вертикальних стійок, болюсів, заглядань у нірки, довжина кроку зменшувались, тоді як час утримання на валу збільшувався порівняно з інтактними тваринами (табл. 1).
Після введення ММСК-ЖТ1 мишам із моделлю паркінсонізму число квадратів, заглядань у нірки, довжина кроку були вище, ніж у контрольній групі, і при цьому не відрізнялись (окрім заглядань у нірки) від значень показників у інтактних тварин (табл. 1).
У мишей, які отримали ін’єкцію ММСК-ЖТ2, число квадратів, заглядань у нірки і довжина кроку також підвищувались порівняно з показниками групи контролю, проте всі їх значення залишались меншими, ніж в інтактних мишей. При цьому після введення ММСК-ЖТ2 число квадратів і заглядань у нірки було меншим, ніж у мишей, які отримали ін’єкцію ММСК-ЖТ1.
У мишей, яким вводили ММСК-ЖТ2 у комбінації з мелатоніном, встановлено підвищення числа заглядань у нірки, довжини кроку й ширини стопи порівняно з групою, яка отримувала тільки ММСК-ЖТ2. При цьому довжина кроку й ширина стопи не відрізнялись від значень показників у інтактних тварин.
Отже, у старіючих мишей під впливом МФТП порушується рухова й немоторна активність. Трансплантація ММСК-ЖТ1 приводить до відновлення низки показників рухової функції, емоційної активності, а також покращує дослідницьку активність таких тварин. Трансплантація ММСК-ЖТ старіючих донорів позитивно впливає на ті ж показники поведінки, що і клітин дорослих донорів, проте цей вплив менш виражений. Крім того, після трансплантації ММСК-ЖТ старіючих донорів зменшується ширина стопи. Введення ММСК-ЖТ старіючих донорів у комбінації з мелатоніном приводить до підсилення позитивного ефекту цих клітин на низку показників рухової активності й дослідницьку активність, а також відновлює значення показника ширини стопи.
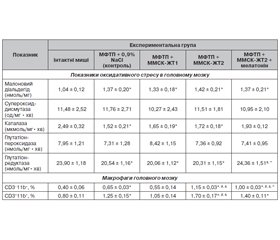
Вплив ММСК-ЖТ дорослих і старіючих мишей-донорів або останніх у комбінації з мелатоніном на показники оксидативного стресу і числа макрофагів у головному мозку мишей із моделлю паркінсонізму. Встановлено, що в головному мозку мишей під дією МФТП зростає вміст МДА і зменшується активність каталази і ГР порівняно з інтактними тваринами (табл. 2). Після введення ММСК-ЖТ1 або ММСК-ЖТ2 значення досліджуваних показників практично не змінювались і не відрізнялись від тих, що були в контрольній групі (табл. 2).
Після введення ММСК-ЖТ2 у комбінації з мелатоніном активність каталази і ГР підвищується і відповідає значенням показників інтактних тварин (табл. 2).
Частка CD3–11b+ і CD3+11b+-клітин у головному мозку мишей із паркінсонізмом зростає під впливом МФТП порівняно з інтактними тваринами (табл. 2). Після трансплантації ММСК-ЖТ1 число згаданих вище клітин зменшується до значень показників у інтактних тварин. Після введення ММСК-ЖТ2 частка CD3–11b+-клітин і CD3+11b+-клітин стає вище, ніж у групі контролю і в мишей, яким вводили ММСК-ЖТ1. Разом з тим після введення ММСК-ЖТ2 у комбінації з мелатоніном частка макрофагів зменшується порівняно з групою, що отримувала тільки клітини; при цьому значення показника залишаються вищими, ніж в інтактної групи мишей.
Отже, під впливом МФТП у головному мозку старіючих мишей порушується баланс факторів оксидативного стресу й антиоксидантного захисту, а також зростає вміст макрофагів. Число макрофагів у головному мозку зменшується до рівня інтактних тварин після трансплантації ММСК-ЖТ дорослих донорів, проте ще більше зростає після трансплантації ММСК від старіючих донорів. Введення ММСК старіючих донорів у комбінації з мелатоніном приводить до підвищення в головному мозку активності низки антиоксидантних ферментів і суттєвого зменшення числа макрофагів.
Обговорення
Вплив МФТП на поведінку, фактори оксидативного стресу, антиоксидантного захисту і вміст макрофагів у головному мозку старіючих мишей. У нашому експерименті дослідження проводили на токсичній МФТП-моделі паркінсонізму. Нами та іншими авторами встановлено, що одноразове введення нейротоксину МФТП у дозі 30 мг/кг призводить до структурних змін нейронів чорної субстанції, інших відділів головного мозку, а також розвитку моторних і немоторних порушень поведінки мишей різного віку [17, 19]. У цій роботі підтверджено, що в старіючих мишей під впливом МФТП спостерігаються значні зміни рухової, емоційної, дослідницької активності та м’язового тонуса.
Відомо, що важливою патогенетичною ланкою морфофункціональних ушкоджень головного мозку при ХП/паркінсонізмі є оксидативний стрес, який розвивається на тлі падіння активності антиоксидантних ферментів [3]. Одним із чинників таких ушкоджень є МДА. Нами встановлено, що після введення МФТП вміст МДА у головному мозку старіючих мишей суттєво зростає, що збігається зі значним падінням активності каталази і ГР.
Крім того, токсична дія МФТП на нейрони чорної субстанції та інших відділів головного мозку може бути опосередкована прозапальними цитокінами (фактор некрозу пухлини (ФНП) альфа, інтерлейкін (ІЛ) бета, інтерферон (ІНФ) гамма), які продукують клітини активованої мікроглії/макрофаги [4, 16]. За нашими даними, у головному мозку старіючих мишей із МФТП-моделлю паркінсонізму частка СD3–11b+- і СD3+11b+-клітин, які за фенотипом належать до макрофагів і активованих макрофагів відповідно [20], значно підвищується.
Отже, у старіючих мишей після введення нейротоксину МФТП виражені зміни поведінки спостерігаються на тлі дисбалансу факторів оксидативного стресу й антиоксидантного захисту, а також підвищення числа макрофагів у головному мозку.
Вікові особливості ефектів ММСК-ЖТ при експериментальному МФТП-індукованому паркінсонізмі. На цей час одним з перспективних підходів до терапії порушень функціонального стану ЦНС при ХП/паркінсонізмі є трансплантація ММСК-ЖТ, на ефективність якої може впливати вік донора [21].
Після трансплантації ММСК-ЖТ дорослих мишей-донорів нами виявлені позитивні зміни рухової і немоторної активності старіючих мишей із МФТП-моделлю паркінсонізму. З літератури відомо, що в молодих мишей із МФТП-моделлю паркінсонізму після трансплантації ММСК-ЖТ молодих донорів покращання моторної активності збігається з підвищенням числа дофамінергічних нейронів у чорній субстанції, а також експресії нейротрофічних (BDNF, GDNF) і хоумінг (SDF) факторів у головному мозку [22, 23]. У даній роботі нами показана можливість покращання поведінки старіючих мишей із цією моделлю паркінсонізму, яким вводили ММСК-ЖТ дорослих тварин. Така ж спрямованість впливу трансплантованих ММСК молодих донорів (пуповина) на поведінку нами була встановлена раніше в старіючих мишей з токсичною моделлю демієлінізації [24].
Серед шляхів позитивних ефектів ММСК-ЖТ при патології ЦНС велике значення має їх антиоксидантний і антизапальний вплив у головному мозку [8, 25, 26]. Є докази того, що при цій патології антиоксидантний ефект ММСК молодих донорів пов’язаний зі зменшенням вмісту реактивних радикалів і підвищенням експресії деяких антиоксидантних ферментів у головному мозку [8, 25]. Проте в даному експерименті ми не спостерігали зменшення проявів оксидативного стресу в головному мозку старіючих мишей із МФТП-моделлю паркінсонізму, яким вводили ММСК-ЖТ дорослих донорів. Разом з тим треба зазначити, що при нейродегенеративній патології в головному мозку, окрім МДА, суттєво зростає вміст ROS (Reactive Oxygen Species), який можна зменшити за допомогою трансплантації ММСК від молодих донорів [27]. Тому не виключено існування подібного шляху антиоксидантного ефекту трансплантованих ММСК-ЖТ дорослих донорів у старіючих мишей із МФТП-моделлю паркінсонізму.
Нами встановлено, що після введення ММСК-ЖТ дорослих мишей-донорів число макрофагів, у тому числі активованих клітин, у головному мозку мишей із МФТП-індукованим паркінсонізмом суттєво зменшується до рівня інтактних тварин. З одного боку показано, що активовані макрофаги продукують прозапальні цитокіни (ФНП-альфа, ІЛ-бетa, ІФН-гамма) [4, 16]. З іншого боку, доведено, що ММСК молодих/дорослих донорів здатні синтезувати IЛ-10, трансформуючий фактор росту бета [28]. Тобто трансплантовані ММСК-ЖТ дорослих тварин виявляють антизапальний ефект у головному мозку старіючих мишей із МФТП-моделлю паркінсонізму, який збігається з покращанням показників поведінки.
При дослідженні ефектів трансплантованих ММСК-ЖТ старіючих донорів у мишей із МФТП-індукованим паркінсонізмом нами виявлено їх позитивний вплив на змінену поведінку. Проте такий вплив був менш вираженим, ніж після введення ММСК дорослих донорів, і спостерігався на тлі подальшого росту числа макрофагів у головному мозку. Скоріше за все цей факт може бути пов’язаний з віковими змінами біологічних властивостей ММСК. Так, встановлено, що з віком спостерігається падіння проліферативного й диференціювального потенціалу ММСК, зміна спектра продукованих клітинами цитокінів, розвиток оксидативного стресу в цих клітинах, зменшення довжини теломер тощо [11, 29].
Отже, вік донорів ММСК-ЖТ має значення для їх впливу на поведінку і прояв антизапальної дії у головному мозку старіючих мишей із МФТП-моделлю паркінсонізму. При цьому позитивні ефекти трансплантованих ММСК-ЖТ дорослих мишей-донорів більш виражені, ніж клітин старіючих донорів.
Ефекти комбінації ММСК-ЖТ старіючих мишей-донорів з мелатоніном при МФТП-індукованому паркінсонізмі. Відомо, що при нейродегенеративній патології протекторний вплив ММСК можна модифікувати за допомогою використання деяких засобів, зокрема гормону мелатоніну [12, 13]. Такий підхід із введенням ММСК пуповини людини в комбінації з мелатоніном уже показав свою ефективність у наших попередніх дослідженнях на старіючих мишах з моделлю розсіяного склерозу [30]. У цій роботі також виявлено позитивні зміни поведінки старіючих мишей із паркінсонізмом після використання комбінації ММСК-ЖТ старіючих донорів із мелатоніном; при цьому значення низки показників поведінки не відрізнялись від тих, які спостерігались після трансплантації ММСК-ЖТ дорослих мишей-донорів.
Дослідженнями авторів встановлено, що при патології ЦНС мелатонін здатен проникати через гематоенцефалічний бар’єр, посилювати нейро-, мієлогенез і синтез BDNF, підвищувати життєдіяльність, проліферацію і диференціювання нейральних стовбурових клітин, чинити антиапоптотичний вплив на нейрони і, як результат, покращувати функціональний стан ЦНС [31]. Крім того, відомі антиоксидантні й антизапальні ефекти мелатоніну при нейродегенеративній патології [32]. Зокрема, встановлено, що при реалізації антиоксидантних властивостей мелатонін діє як прямий і непрямий антиоксидант. Нами виявлена активація антиоксидантних ферментів (каталаза, ГР) у головному мозку старіючих мишей із МФТП-моделлю паркінсонізму, яким вводили ММСК-ЖТ старіючих мишей-донорів у комбінації з мелатоніном. У таких тварин також зменшується число макрофагів у головному мозку. Тому ми не виключаємо, що позитивний вплив комбінації ММСК-ЖТ старіючих донорів і мелатоніну на поведінку старіючих мишей з паркінсонізмом частково пов’язаний з посиленням антиоксидантного захисту головного мозку і падінням в ньому числа макрофагів із прозапальною активністю. Крім того, можна думати, що в позитивних ефектах комбінації ММСК-ЖТ старіючих донорів з мелатоніном саме гормону належить значна роль у їх реалізації. Нами раніше виявлені антиоксидантні й антизапальні властивості екзогенного мелатоніну в старіючих мишей з моделлю паркінсонізму [15].
Окрім нейропротекторної дії, авторами показано позитивний ефект мелатоніну на біологічні властивості трансплантованих ММСК. Так, мелатонін впливає на диференціювання ММСК і захищає ці клітини від загибелі, що може досягти 90 % у перші 72 год після їх трансплантації в організм з патологією [33, 34]. Крім того, під впливом мелатоніну продукція таких прозапальних факторів, як ФНП-альфа і IЛ-6, знижується в ММСК різного тканинного походження [13, 33]. Цей гормон регулює експресію гена NADPH оксидази в ММСК, який генерує ROS, a також активує експресію генів для антиоксидантних ферментів у цих клітинах [12, 34]. Тому можна вважати, що згадані вище властивості мелатоніну важливі для забезпечення проявів регенераторних ефектів ММСК-ЖТ старіючих мишей-донорів при МФТП-індукованому паркінсонізмі.
Отримані результати можуть бути підґрунтям для розробки підходів із застосуванням мелатоніну до підвищення ефективності клітинної терапії паркінсонізму, зокрема при використанні ММСК-ЖТ старіючих донорів. Результати також поглиблюють наші уявлення щодо проявів вікових змін біологічних властивостей ММСК-ЖТ при нейродегенеративній патології, а також значення мелатоніну для таких змін.
Висновки
1. У старіючих мишей із МФТП-моделлю паркінсонізму спостерігається порушення поведінкових реакцій, підвищення в головному мозку числа макрофагів, вмісту МДА і падіння активності антиоксидантних ферментів.
2. Трансплантація ММСК-ЖТ дорослих мишей-донорів приводить до позитивних змін низки показників моторної і немоторної активності, а також відновлення числа макрофагів у головному мозку старіючих мишей з моделлю паркінсонізму.
3. Позитивний ефект трансплантованих ММСК-ЖТ старіючих донорів на змінені показники поведінки мишей того ж віку з моделлю паркінсонізму менш виражений порівняно з клітинами від дорослих донорів, що спостерігається на тлі зростання числа макрофагів у головному мозку.
4. Введення ММСК-ЖТ старіючих донорів у комбінації з мелатоніном приводить до підсилення позитивного впливу цих клітин на показники рухової і дослідницької активності старіючих мишей з паркінсонізмом, зменшує ступінь підвищення числа макрофагів у головному мозку і сприяє відновленню активності низки антиоксидантних ферментів.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
Отримано/Received 31.06.2022
Рецензовано/Revised 15.07.2022
Прийнято до друку/Accepted 29.07.2022
Список литературы
1. Sulzev D., Surmeiter D.J. Neuronal vulnerability, pathogenests and Parkinson’s disease. Mov. Disord. 2013. Vol. 28. P. 715-724. doi: 10.1002/mds.25095.
2. Karaban I.N., Karaban N.V., Karasevych N.V. The ways of neuroprotection in Parkinson’s disease. International neurological journal. 2011. № 6(44). P. 95-99.
3. Guo J.-D., Zhao X., Li Y., Li G.-R., Liu X.-L. Damage to dopaminergic neurons by oxidative stress in Parkinson’s disease (Review). Int. J. Mol. Med. 2018. Vol. 41. P. 1817-1825. doi:10.3892/ijmm.2018.3406.
4. Wang Q., Liu Y., Zhou J. Neuroinflammation in Parkinson’s disease and its potential as therapeutic target. Translat. Neurodegenerat. 2015. 4. 19. doi: 10.1186/s40035-015-0042-0.
5. Li Zh., Cheung H.-H. Stem cell-based therapies for Parkinson desease. Int. J. Mol. Sci. 2020. Vol. 21. 8060. doi: 10.3390/ijms21218060.
6. Konala V.B., Mamidi M.K., Bhonde R., Das A.K., Pochampally R., Pal R. The current landscape of the mesenchymal stromal cell secretome. Cytotherapy. 2016. Vol. 18. P. 13-24. DOI:10.1016/j.jcyt.2015.10.008.
7. Zachar L., Bacenlova D., Rosocher I. Activation, homing and role of the mesenchymal stem cells in the inflammatory environment. J. Inflamm. Res. 2016. Vol. 9. P. 231-240. DOI:10.2147/JIR.S121994.
8. Wojtas E., Zachwieja A., Zwyrzykowska A., Kupczynski R., Marycz K. The application of mesenchymal progenitor stem cells in the reduction of oxidative stress in animals. Turk. J. Biol. 2017. Vol. 41. P. 12-19. DOI:10.3906/biy-1603-13.
9. Laroni A., Kerlego de Rosbo N., Uccelli A. Mesenchymal stem cells for the treatment of neurological diseases: immunoregulation beyond neuroprotection. Immunology Letter. 2015. Vol. 168. P. 183-190. http://dx.doi.org/10.1016/j.imlet.2015.08.007.
10. Scruggs B. A., Semon J. A., Zhang X., Zhang Sh., Bowles A.S., Pandey A.C. et al. Age of the donor reduces the ability of human adipose derived stem cells to alleviate symptoms in the experimental autoimmune encephalomyelitis mouse model. Stem Cells Transl. Med. 2013. Vol. 2. P. 797-807. http://dx.doi.org/10.5966/sctm.2013-0026.
11. Li Yi., Wu Q., Wang Y., Li Li, Bu H., Bao J. Senescence of mesenchymal stem cells (Review). Int. J. Mol. Med. 2017. Vol. 39. P.775-782. Doi:10.3892/ijmm.2017.2012.
12. Hu Ch., Li L. Melatonin plays critical role in mesenchymal stem cell-based regenerative medicine in vitro and in vivo. Stem Cell Res. Ther. 2019. Vol. 10. Article number 13. DOI: 10.1186/s13287-018-1114-8.
13. Zhang S., Chen S., Li Y., Liu Y. Melatonin as a promising agent of regulatory stem cell biology and its application in disease therapy. Pharmacol. Res. 2017. Vol. 117. P. 252-260. DOI: 10.1016/jphrs.2016.12.035.
14. Labunets I.F. Neuroprotective еffects of the pineal hormone melatonin in animals with experimental model of neurodegenerative pathology. Conceptual options for the development of medical science and education. Baltija Bublishing. 2020. P. 355-370. doi: 10.30525/978-9934-588-44-01/18.
15. Лабунец И.Ф., Утко Н.А., Пантелеймонова Т.Н., Бутенко Г.М. Влияние экзогенного мелатонина на показатели поведения и оксидативного стресса в головном мозге стареющих мышей с экспериментальными моделями патологии нервной системы. Международный неврологический журнал. 2021. Т. 17. № 2. С. 37-43. https://doi.org/10.22141/2224-0713.17.2.2021.229893.
16. Zeng X.S., Geng W.Sh., Jia J.J. Neurotoxin-induced animal models of Parkinson disease: pathogenic mechanism and assessment. ASN Neuro. 2018. Vol. 10. P. 1-15. doi:10.1177/175909/418777438.
17. Labunets I.F., Utko N.A., Savosko S.I., Panteleymonova T.N., Butenko G.M. Changes in nigral neuronal structure, indices of antioxidant protection of the brain and behavior in mice of different age with MPTP parkinsonism model. International Neurological Journal. 2020. № 3(16). P. 7-15. doi: 10.22141/2224-0713.16.3.2020.203444.
18. Родніченко А.Є. Деякі біологічні властивості мультипотентних мезенхімальних стромальних клітин кісткового мозку та жирової тканини мишей лінії FVB/N. Клітинна та органна трансплантологія. 2017. Т. 5. № 2. С. 188-193. Doi:10.22494/cot.v5i2.77.
19. Huang D., Xu J., Wang J., Tong J., Bai X., Li H. et al. Dynamic changes in the nigrostrial pathway in the MPTP mouse model of Parkinson’s desease. Parkinson disease. 2017. Article ID 9349487. 7p. https://doi.org/10.1155/2017/9349487.
20. Rodriguez-Cruz A., Vesin D., Ramon-Luing L., Zuniga J., Quesniaux V.F.J., Ryffel B. et al. CD3+ macrophages deliver proinflammatory cytokines by a CD3– and transmembrane TNF-dependent pathway and are increased at the BCG-infection site. Front. Immunol. 2019. Vol. 10. Article 2550. doi:10.3389/fimmu.2019.02550.
21. Li K., Li X., Shi G., Lei X., Huang Y., Bai L. et al. Effectiveness and mechanisms of adipose-derived stem cell therapy in animal models of Parkinson’s desease: a systematic review and meta-analysis. Translat. Neurodegenerat. 2021. Vol. 10. 14. Doi.org/10.1186/s40035-021-00238-1.
22. Park H., Chang K.A. Therapeutic Potential of Repeated Intravenous Transplantation of Human Adipose-Derived Stem Cells in Subchronic MPTP-induced Parkinson’s Disease Mouse Model. Int. J. Mol. Sci. 2020. Vol. 21. 8129. doi:10.3390/ijms21218129.
23. Chi K., Fu R.-H., Huang Yu.-Ch., Chen Sh.-Y., Hsu –Ch.-J., Lin Sh.-Z. et al. Adipose-derived Stem Cells Stimulated with n-Butylidenephthalide Exhibit Therapeutic Effects in a Mouse Model of Parkinson's Disease. Cell. Transplantation. 2018. Vol. 27. № 3. P. 456-470. Doi:10.1177/0963689718757408.
24. Лабунец И.Ф., Утко Н.А., Топорова Е.К., Пантелеймонова Т.Н., Родниченко А.Е., Бутенко Г.М. Влияние мультипотентных мезенхимальных стромальных клеток пуповины человека на показатели поведения и оксидативного стресса в головном мозге мышей разного возраста с токсической купризоновой моделью демиелинизации. Клеточная и органная трансплантология. 2020. Т. 8. № 1. С. 32-37. Doi:10.22494/cot.v8i1.106.
25. Angeloni C., Gatti M., Prata C., Hrelia S., Maraldi T. Role of mesenchymal stem cells in counteracting oxidative stress-related neurodegeneration. Int. J. Mol. Sci. 2020. Vol. 21. 3299. doi:10.3390/ijms21093299.
26. Munoz M.F., Arguelles S., Medina R., Cano M., Ayala A. Adipose-derived stem cells decreased nicroglia activation and protected dopaminergic loss in rat lipopolysacccharide model. J. Cell. Physiol. 2019. Vol. 234. P. 13762-13772. Doi.org/10.1002/jcp.28055.
27. Chierchia A., Chirico N., Boeri L., Raimondi I., Riva G.A., Raimondi M.T. et al. Secretome released from hydrogel-embedded adipose mesenchymal stem cells protects against the Parkinson’s disease related toxin 6-hydroxydopamine. Eur. J. Pharm. Biopharm. 2017. Vol. 121. P. 113-120. doi: org/10.1016/j.ejpb.2017.09.014.
28. Putra A., Ridwan B.R., Putridewi A.I., Kutstiyah A.R., Wirastuti K., Sadyah N.A.Ch. et al. The role of TNF-alpha induced MSCs on suppressive inflammation by increasing TGF-beta and IL-10. Open Access Mased. J. Med. Sci. 2018. Vol. 6. № 10. P. 1179-1783. Doi:10.3889/oamjms.2018.404.
29. Zhang D., He Sh., Wang Q., Pu Sh., Zhou Z., Wu Q. Impact of aging on the characterization of brown and white adipose tissue-derived stem cells in mice. Cells Tisuess Organs. 2020. Published online: June 11, 2020. doi: 10.1159/000507434.
30. Labunets I.F., Utko N.A., Toporova O.K. Effects of multipotent mesenchymal stromal cells of the human umbilical cord and their combination with melatonin in adult and aging mice with a toxic cuprizone model of demyelination. Adv. Gerontol. 2021. Vol. 11. № 2. P. 173-180. doi:10.1134/S2079057021020077.
31. Yu X., Li Zh., Zheng H., Ho J., Chan M. T.V., Wu W.K.K. Protective roles of melatonin in central nervous system disease by regulation of neural stem cells. Cell Prolif. 2017. Vol. 50. № 2. e12323. DOI: 10.1111/cpr.12323.
32. Chen D., Zhang T., Lee T.H. Cellular mechanisms of melatonin: insight from neurodegenerative diseases. Biomolecules. 2020. Vol. 10. 1158. doi:10.3390/biom10081158.
33. Luchetti F., Canonico B., Bartolini D., Arcangeletti M., Ciffolilli S., Murdolo G. et al. Melatonin regulates mesenchymal stem cell differentiation: a review. J. Pineal Res. 2014. Vol. 56. P. 382-397. DOI:10.1111/jpi.12133.
34. Tan Sh.S., Han X., Sivakumaran P., Lim Sh.Y., Morrison W.A. Melatonin protects human adipose-derived stem cells from oxidative stress and cell death. APS. 2016. Vol. 43. № 3. P. 237-241.Doi.org/10.5999/aps.2016.43.3.237.

/8.jpg)
/9.jpg)