Международный неврологический журнал Том 18, №4, 2022
Вернуться к номеру
Клінічна оцінка ефективності нейропротекторної терапії в дітей з порушеннями мовленнєвого й когнітивного розвитку
Авторы: Кирилова Л.Г., Мірошников О.О.
ДУ «Інститут педіатрії, акушерства і гінекології імені академіка О.М. Лук’янової НАМН України», м. Київ, Україна
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
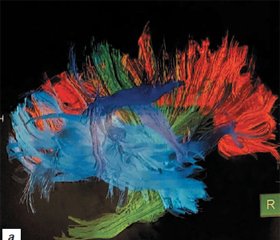
Актуальність. Пошук нових методів нейропротекторної і нейрометаболічної терапії у дітей з розладами нейророзвитку є важливим завданням сучасної дитячої неврології. До перспективних засобів впливу на когнітивні й мовленнєві функції у дітей з розладами аутистичного спектра належить, зокрема, Когнітіум. Мета: оцінити клінічну ефективність застосування засобу Когнітіум у дітей з розладами нейророзвитку, що супроводжуються порушеннями когнітивного й мовленнєвого розвитку, та оцінити вплив його застосування за допомогою клінічних і об’єктивних методів дослідження. Матеріали та методи. У дослідження було включено 50 дітей з порушеннями когнітивного й мовленнєвого розвитку віком від 2 до 7 років (середній вік 4,3 ± 2,2 року). Обстежені діти були розподілені на дві групи: I група (основна) — діти від 2 до 7 років, які отримували засіб Когнітіум протягом 60 днів (30 осіб); II група (група порівняння) — діти від 2 до 7 років, які не отримували засіб Когнітіум (20 осіб). Усім дітям було проведено загальноклінічне й неврологічне обстеження, відеоелектроенцефалографічний моніторинг, тестування за шкалами Autism Treatment Evaluation Checklist (АТЕС) і Global clinical impression (CGI-I). Також 10 дітям було проведено магнітно-резонансну томографію головного мозку і магнітно-резонансну (МР) трактографію до початку і після закінчення лікування. Результати. Після курсу лікування проведено оцінювання за шкалою CGI-I, згідно з якою у 83,3 % дітей зміни в результаті лікування оцінені як позитивні, при цьому в 13,3 % дітей відзначалося дуже значне покращання, у 46,7 % — значне покращання, у 23,3 % — мінімальне покращання. Лише у 5 дітей (16,7 %) не відзначено жодних позитивних змін у результаті лікування. За шкалою ATEC у дітей основної групи було виявлено зменшення кількості балів за субшкалами I (мовлення і комунікативні функції) і III (сенсорні й когнітивні функції), а також загальної кількості балів, що свідчить про покращання мовленнєвих і когнітивних навичок після проведеного курсу лікування. За результатами МР-трактографії в обстежених відзначалося збільшення середніх показників фракційної анізотропії і вимірюваного коефіцієнту дифузії в передніх і задніх відділах дугоподібного тракту домінантної півкулі, що свідчить про покращання мієлінізації центрів Брока і Верніке, а також обох гачкоподібних трактів, які відповідають за розвиток когнітивних функцій. Висновки. Проведене дослідження дозволяє стверджувати, що нейропротекторний засіб Когнітіум доцільно призначати дітям віком від 2 років з метою покращання когнітивного й мовленнєвого розвитку в комплексі з іншими лікувально-корекційними заходами на термін не менше ніж 60 днів.
Background. Searching for new methods of neuroprotective and neurometabolic therapy in children with neurodevelopmental disorders is an important task of modern pediatric neurology. Cognitium is a perspective agent for influencing cognitive and speech functions in children with autism spectrum disorders. The purpose of the study was to evaluate the clinical effectiveness of Cognitium in children with neurodevelopmental disorders accompanied by disorders of cognitive and language development and to evaluate its impact using clinical and objective research methods. Materials and methods. Fifty children with cognitive and language development disorders aged 2 to 7 years (average age of 4.3 ± 2.2 years) were included in the study. The examined patients were divided into two groups: group I (main group) — 30 children aged 2 to 7 years who received Cognitium for 60 days; group II (comparison group) — 20 children aged 2 to 7 years who did not received Cognitium. All patients underwent a general clinical and neurological examination, video electroencephalography monitoring, testing by Autism Treatment Evaluation Checklist (ATEC) and Clinical Global Impression (CGI-I) scale. Also, 10 children underwent brain magnetic resonance (MR) imaging and MR tractography before and after treatment. Results. After the course of treatment, an assessment was made by the CGI-I scale according to which the changes were positive in 83.3 % of children, while 13.3 % of patients showed a very significant improvement, 46.7 % — a significant improvement, 23.3 % — a minimal improvement. Only 5 children (16.7 %) did not notice any positive changes as a result of treatment. According to the ATEC, the children of the main group showed a decrease in the number of points by scales I (language and communicative functions) and III (sensory and cognitive functions), as well as in the total number of points, which indicates an improvement in language and cognitive skills after the course of treatment. The results of MR tractography showed an increase in the average fractional anisotropy and the measured diffusion coefficient in the anterior and posterior parts of the arcuate tract of the dominant hemisphere that indicates an improvement in the myelination of Broca’s and Wernicke’s areas, as well as both arcuate tracts, which are responsible for the development of cognitive functions. Conclusions. The conducted study allows us to state that the neuroprotective agent Cognitium should be prescribed to children aged 2 years and older in order to improve cognitive and language development in combination with other medical and corrective measures for at least 60 days.
розлади нейророзвитку; розлади аутистичного спектра; когнітивні функції; нейропротекторна терапія; МР-трактографія; засіб Когнітіум
neurodevelopmental disorders; autism spectrum disorders; cognitive functions; neuroprotective therapy; magnetic resonance tractography; Cognitium
Вступ
Матеріали та методи
Результати та обговорення
/21.jpg)
/21_2.jpg)
Висновки
- Zeidan J., Fombonne E., Scorah J., Ibrahim A., Durkin M.S., Saxena S. et al. Global prevalence of autism: A systematic review update. Autism research: official journal of the International Society for Autism Research. 2022. 10.1002/aur.2696. Advance online publication. https://doi.org/10.1002/aur.2696
- Morris-Rosendahl D.J., Crocq M.A. Neurodevelopmental disorders — the history and future of a diagnostic concept. Dialogues in clinical neuroscience. 2020. 22(1). 65-72. https://doi.org/10.31887/DCNS.2020.22.1/macrocq.
- American Psychiatric Association. Diagnostic and Statistical Manual of Mental Disorders. 5th Edition (DSM-5). Washington, DC: American Psychiatric Association, 2013.
- Srivastava S., Sahin M. Autism spectrum disorder and epileptic encephalopathy: common causes, many questions. Journal of neurodevelopmental disorders. 2017. 9. 23. https://doi.org/10.1186/s11689-017-9202-0.
- Кирилова Л.Г., Мирошников А.А., Юзва А.А. Эпилептические энцефалопатии у детей с расстройствами аутистического спектра: от молекулярно-генетической диагностики до таргетной терапии. Психиатрия, психотерапия и клиническая психология. 2021. № 2(12). С. 249-259. Scopus Q4 DOI 10.34883/PI.2021.12.2.006.
- Кирилова Л.Г., Юзва О.О., Мирошников О.О. Клинико-генетические аспекты нарушений развития речи, ассоциированных с эпилептическими энцефалопатиями и расстройствами аутистического спектра у детей. Педиатрия. Восточная Европа. 2021. Т. 9. № 3. С. 456-468. https://www.elibrary.ru/item.asp?id=47079155
- Кирилова Л.Г., Мирошников А.А., Юзва А.А. Когнитивная дезинтеграция как расстройство нейроразвития детского возраста: классификация, диагностика и возможности терапии. Педиатрия. Восточная Европа. 2021. Т. 9. № 1. С. 63-78.
- Precenzano F., Parisi L., Lanzara V., Vetri L., Operto F.F., Pastorino G. et al. Electroencephalographic Abnormalities in Autism Spectrum Disorder: Characteristics and Therapeutic Implications. Medicina (Kaunas, Lithuania). 2020. 56(9). 419. https://doi.org/10.3390/medicina56090419.
- Tuchman R. Autism and epilepsy: what has regression got to do with it? Epilepsy currents. 2006. 6(4). 107-111. https://doi.org/10.1111/j.1535-7511.2006.00113.x.
- Al Backer N.B. Developmental regression in autism spectrum disorder. Sudanese Journal of Paediatrics. 2015. 15(1). 21-26.
- Stafstrom C.E., Benke T.A. Autism and Epilepsy: Exploring the Relationship Using Experimental Models. Epilepsy currents. 2015. 15(4). 206-210. https://doi.org/10.5698/1535-7511-15.4.206.
- Uchida D., Fujimoto A., Yamazoe T., Yamamoto T., Enoki H. Seizure frequency can be reduced by changing intracranial pressure: A case report in drug-resistant epilepsy. Epilepsy & Behavior Case Reports. 2018. 10. 14-17. https://doi.org/10.1016/j.ebcr.2017.12.005.
- Ebrahimi-Fakhari D., Sahin M. Autism and the synapse: emerging mechanisms and mechanism-based therapies. Current opinion in neurology. 2015. 28(2). 91-102. https://doi.org/10.1097/WCO.0000000000000186.
- Blasi A., Lloyd-Fox S., Sethna V., Brammer M.J., Mercure E., Murray L., Williams S.C., Simmons A., Murphy D.G., Johnson M.H. Atypical processing of voice sounds in infants at risk for autism spectrum disorder. Cortex. 2015. 71. 122-133. https://doi.org/10.1016/j.cortex.2015.06.015.
- Braukmann R., Lloyd-Fox S., Blasi A., Johnson M.H., Bekkering H., Buitelaar J.K., Hunnius S. Diminished socially selective neural processing in 5-month-old infants at high familial risk of autism. The European Journal of Neuroscience. 2018. 47(6). 720-728. https://doi.org/10.1111/ejn.13751.
- Johnson M.H. Autism as an adaptive common variant pathway for human brain development. Developmental Cognitive Neuroscience. 2017. 25. 5-11. https://doi.org/10.1016/j.dcn.2017.02.004.
- Cheng N., Rho J.M., Masino S.A. Metabolic Dysfunction Underlying Autism Spectrum Disorder and Potential Treatment Approaches. Frontiers in molecular neuroscience. 2017. 10. 34. https://doi.org/10.3389/fnmol.2017.00034.
- Кириллова Л.Г., Мирошников А.А., Юзва А.А. Расстройства аутистического спектра у детей раннего возраста: эволюция взглядов и возможности диагностики (часть 2). Международный неврологический журнал. 2020. Т. 16(5). С. 48-53.
- Мартинюк В.Ю., Борщенко Т.В., Майструк О.А. Когнум як м’який соціальний адаптоген для корекції проявів шкільної дезадаптації. Здоровье ребенка. 2022. Т. 17. № 1.
- Танцура Л.М., Пилипець О.Ю., Третьяков Д.В. Концепція виникнення мінімальної мозкової дисфункції та можливі шляхи запобігання її розвитку. Український вісник психоневрології. 2016. Т. 24. Вип. 4. С. 5-7. http://nbuv.gov.ua/UJRN/Uvp_2016_24_4_3.
- Кирилова Л.Г., Мірошников О.О. Нейропротекторна терапія при неврологічних ураженнях у дітей раннього віку з пре- та перинатальною патологією. Український медичний часопис. 2015. № 4. С. 37-42. http://nbuv.gov.ua/UJRN/UMCh_2015_4_14.
- Martinez M.A., Florenzano N.V., Macchia E.A. Metabolismodel N-acetil-L-aspartato: valor diagnostico y pronostico [Meta–bolism of N-acetyl-L-aspartate: its diagnostic and prognostic value]. Revista de Neurología. 2016. 62(8). 361-370.
- Warepam M., Moffett J.R., Ross B., Arun P., Madhavarao C.N., Namboodiri A.M. N-Acetylaspartate in the CNS: from neurodiagnostics to neurobiology. Progress in neurobiology. 2007. 81(2). 89-131. https://doi.org/10.1016/j.pneurobio.2006.12.003.
- Ahmad K., Rahman S., Rahaman H., Kumari K., Singh L.R. N-Acetylaspartate Is an Important Brain Osmolyte. Biomolecules. 2020. 10(2). 286. https://doi.org/10.3390/biom10020286.
- Moffett J.R., Tieman S.B., Weinberger D.R., Coyle J.T., Namboodiri M.A. N-Acetylaspartate: A Unique Neuronal Molecule in the Central Nervous System. NewYork, NY: Springer Science + Business Media; 2006. [GoogleScholar]

/22.jpg)
/23.jpg)