Вступ
Діабетична невропатія — поширене неврологічне захворювання, яке є частим ускладненням цукрового діабету. Досягнення останніх років у лікуванні цукрового діабету дозволили покращити рівень виживання та збільшити тривалість життя пацієнтів, що призвело до збільшення кількості ускладнень, таких як невропатія, ретинопатія, васкулопатія. Часто ці ускладнення є більш інвалідизуючими, ніж основне захворювання [1, 2].
У патофізіології невропатії важливу роль відіграє пошкодження шваннівських клітин, які продукують мієлін, що при тривалому процесі може призводити до порушення структури і функції аксона. Пошкодження мієлінової оболонки може варіювати за ступенем вираженості та клінічно проявлятися у вигляді сенсорної, моторної чи вегетативної дисфункції в ділянці іннервації пошкодженого периферичного нерва [3]. Відновлення стану і функції мієлінової оболонки є ключовим завданням у лікуванні невропатії будь-якого генезу.
Важливий вплив на мієлінову оболонку має гомоцистеїн. При стані гіпергомоцистеїнемії, коли кількість гомоцистеїну збільшується, він чинить токсичну дію і сприяє пошкодженню мієлінової оболонки. Ці ефекти реалізуються через активацію процесів оксидативного стресу і порушення функції ендотелію, що призводить до ішемії та апоптозу шваннівських клітин [4].
Нуклеотиди, такі як уридин і цитидин, показали свою ефективність у відновленні пошкодженої мієлінової оболонки периферичних нервів. В експериментальних дослідженнях на тваринах зі штучно пошкодженим сідничним нервом було показано прискорення та підсилення нервової провідності, а також пригнічення передачі больових стимулів у спинному мозку на фоні застосування уридину і цитидину [5]. Відомо, що ці нуклеотиди здатні підсилювати активність процесів транскрипції і трансляції при пошкодженні периферичного нерва [6, 7].
У фундаментальних дослідженнях була показана здатність фолієвої кислоти (вітаміну B9) та ціанокобаламіну (вітаміну B12) прискорювати та збільшувати відновлення нервових волокон шляхом стимуляції синтезу фосфоліпідів, гліколіпідів та протеїнів, які є основними структурними елементами мембрани нейрона [8, 9].
Ціанокобаламін (вітамін В12) та фолієва кислота (вітамін В9) беруть участь у реакціях інактивації гомоцистеїну [10]. Якщо рівень ціанокобаламіну та фолієвої кислоти в організмі людини є достатнім, рівень гомоцистеїну теж знаходиться в межах норми. Але, за статистикою, майже кожен другий пацієнт з цукровим діабетом приймає метформін [11], що призводить до зниження абсорбції вітамінів В9 та В12 у кишечнику, що, у свою чергу, призводить до розвитку стану гіпергомоцистеїнемії [10].
Отже, виходячи з базових біохімічних реакцій, прийом нуклеотидів з метою регенерації мієлінової оболонки не буде ефективним без нормалізації (зниження) рівня гомоцистеїну, чого можна досягнути шляхом прийому ціанокобаламіну та фолієвої кислоти.
Засіб Мієлофан містить у своєму складі 50 мг уридин-5-монофосфату динатрієвої солі (у перерахунку 33,17 мг уридину), 5 мг цитидин-5-монофосфату, 0,5 мг вітамінуB9 (фолієвої кислоти) та 5 мкг вітаміну В12 (ціанокобаламіну). Такий оптимальний склад дозволяє об’єднати наведені вище терапевтичні властивості окремих речовин.
Мета дослідження: оцінити аналгетичну активність, клінічну динаміку, а також динаміку нейрофізіологічних показників за даними електронейроміографії (ЕНМГ) на фоні застосування Мієлофану при діабетичній невропатії.
Матеріали та методи
До групи спостереження увійшли 20 пацієнтів з компенсованим цукровим діабетом II типу та діабетичною невропатією.
Пацієнти приймали Мієлофан по 1 капсулі 1 раз на день під час їжі, запиваючи достатньою кількістю питної води, протягом 56 днів (8 тижнів).
Кожен пацієнт був поінформований про мету прийому Мієлофану та підписав інформовану згоду на участь у дослідженні. Пацієнтам не заборонялось приймати інші лікарські засоби з аналгетичною чи будь-якою іншою метою. Усі пацієнти були обстежені та лікувалися амбулаторно. Обстеження починалося з клініко-неврологічного огляду, за результатами якого проводився відбір пацієнтів згідно з критеріями включення і виключення.
Критерії включення:
— встановлений діагноз цукрового діабету II типу, стадія компенсації, діабетична невропатія;
— вік пацієнтів від 18 до 65 років;
— тривалість захворювання ≥ 12 місяців;
— інтенсивність болю за візуальною аналоговою шкалою (ВАШ) ≥ 4;
— наявність змін у нервовій провідності за даними ЕНМГ нижніх кінцівок.
Критерії виключення:
— ішемічна хвороба серця з частими нападами стенокардії;
— порушення ритму і провідності, небезпечні для життя;
— стійка, з високими цифрами артеріальна гіпертонія;
— перенесений менше ніж 1 рік тому інфаркт міокарда;
— серцева недостатність 2–3-го ступеня;
— ниркова недостатність;
— злоякісні новоутворення і хвороби крові;
— вагітність і годування груддю.
Кожен пацієнт проходив обстеження за єдиною схемою. Неврологічне обстеження включало детальне сенсорне тестування з метою виявлення зон алодинії чи гіпестезії. У випадку виявлення таких зон проводилося вимірювання їх площі у квадратних сантиметрах. Інтенсивність болю визначалася в балах за ВАШ.
Для визначення наявності невропатичного компонента болю застосовувався опитувальник painDETECT. Опитувальник складається із семи запитань, що стосуються якісних характеристик невропатичних симптомів болю, які оцінюються за п’ятибальною шкалою. Також опитувальник включає визначення характерного патерну болю і наявності іррадіації болю, яка сама по собі є дуже явною невропатичною ознакою. Максимальна кількість балів, яка можлива за опитувальником, — 38. Результат від 0 до 12 балів говорить про малу (< 15 %) ймовірність невропатичного компонента. Результат від 13 до 18 балів є невизначеним, однак не виключає наявність невропатичного компонента болю. Результат від 19 до 38 балів є позитивним і говорить про високу (> 90 %) ймовірність наявності невропатичного компонента болю.
Для визначення наявності ознак центральної сенситизації використовувався опитувальник із центральної сенситизації, який складається з двох частин. Частина А включає 25 запитань, пов’язаних з клінічними проявами центральної сенситизації. На кожне запитання можна дати один з 5 варіантів відповідей за шкалою Лайкерта: ніколи (0 балів), рідко (1 бал), іноді (2 бали), часто (3 бали) або завжди (4 бали). Центральна сенситизація вважається вираженою при результаті 40 балів і більше [12]. Частина В опитувальника не береться до уваги при підрахунку балів, проте в ній пацієнт може вказати, чи встановлювалися йому раніше діагнози (фіброміалгія, синдром хронічної втоми, дисфункція скронево-нижньощелепного суглоба, синдром подразненої кишки, мігрень або головний біль напруги, множинна хімічна чутливість і синдром неспокійних ніг), які так чи інакше пов’язані з явищами центральної сенситизації.
Госпітальна шкала тривоги і депресії (HADS) використовується для швидкого виявлення тривоги та депресії в амбулаторній клінічній практиці. Вона є простою і не викликає складнощів у пацієнта при заповненні, а сам процес зазвичай займає декілька хвилин. Шкала складається з двох частин: перша частина (7 запитань, 4 варіанти відповіді на кожне) визначає рівень тривоги, друга частина (7 запитань, 4 варіанти відповіді на кожне) визначає рівень депресії. Кількість балів за двома розділами шкали сумується. Максимальна кількість балів — 42. Пацієнт отримує рекомендації довго не розмірковувати над відповідями, перша відповідь, що спала на думку, зазвичай найвірніша. Пацієнта просять дати відповіді щодо свого стану за останні 7 днів. Отриманий за шкалою результат не потребує тривалого часу для інтерпретації лікарем. Кількість балів за кожною із шкал інтерпретується наступним чином: від 0 до 7 балів відповідає нормі, від 8 до 10 балів — субклінічно вираженій тривозі/депресії, 11 балів і більше — клінічно вираженій тривозі/депресії.
Опитувальник EuroQol-5D дозволяє оцінити якість життя за п’ятьма показниками: мобільність, догляд за собою, звична повсякденна діяльність, біль та дискомфорт, тривожність та депресія. Відповіді, дані пацієнтом, можуть свідчити про наявність одного із 245 варіантів стану здоров’я, який може бути конвертований в індекс опитувальника від 0 (смерть) до 1 (повне здоров’я). Також опитувальник містить ВАШ, на якій респонденти мають змогу відмітити статус свого здоров’я від 0 (найгірший стан здоров’я, який тільки можна уявити) до 10 (найкращий можливий стан здоров’я) [13].
Шкала катастрофізації болю визначає схильність пацієнта до перебільшення негативної оцінки пошкоджень при спогаді про ситуацію болю. Вона складається з трьох вимірів (субшкал). 1. Уявна жуйка. Cюди входять нав’язливі думки, тривога, нездатність протистояти думкам про біль. 2. Перебільшення. Cюди входить переоцінка тяжкості болю, очікування негативних наслідків. 3. Безнадійність. Cюди входить переживання болю, нездатність впоратися з болем. Шкала складається з 13 тверджень, кожне з яких пацієнт повинен оцінити за п’ятибальною шкалою, у якій 0 оцінюється як відсутність катастрофізації, 4 — як максимальний її рівень [14].
Для визначення наявності змін у нервово-м’язовій провідності та їх динаміки проводилось електронейроміографічне дослідження з визначенням швидкості поширення збудження (ШПЗ) по сенсорних і моторних волокнах нижніх кінцівок. Досліджувались такі моторні волокна зліва і справа: nervus tibialis з musculus аbductor hallucis та nervus рeroneus з musculus еxtensor digitorum brevis. Також досліджувались такі сенсорні волокна зліва і справа: nervus рeroneus superficialis та nervus suralis.
Обстеження пацієнтів проводилося в 1-й день, а також на 14, 28, 42 та 56-й дні від початку лікування. Деталі дизайну спостереження наведені в табл. 1.
/15.jpg)
Статистична обробка матеріалу проводилася за допомогою комп’ютерної програми SPSS 17. Нормальність розподілу даних кількісного типу визначали за допомогою критерію Шапіро — Уїлка. Кількісні дані описували середнім значенням і стандартним відхиленням, для їх визначення використовувалася програма описової статистики. Якісні змінні описувалися частотою і відсотком представленості. Вірогідність відмінностей між вибірками з нормальним розподілом визначалася за допомогою критерію Стьюдента для незалежних вибірок, для вибірок з ненормальним розподілом використовувався непараметричний критерій Манна — Уітні для незалежних вибірок. При порівнянні пов’язаних вибірок з нормальним розподілом використовувався критерій Стьюдента для пов’язаних вибірок, для вибірок з ненормальним розподілом використовувався критерій Вілкоксона. Рівень статистичної вірогідності при всіх розрахунках був встановлений як P < 0,05.
Результати
Середній вік пацієнтів становив 61,80 ± 7,38 року, кількість чоловіків — 7 (35 %), кількість жінок — 13 (65 %). Середня інтенсивність болю за ВАШ становила 6,60 ± 1,54 бала, що відповідало вираженому рівню болю. У 16 (80 %) пацієнтів були наявні ділянки алодинії — зон, ніжний дотик до яких викликав відчуття болю, та гіпестезії — зон зниження чутливості. Площа ділянок алодинії коливалась від 10 до 50 см2, середня площа становила 19,25 ± 18,38 см2, площа ділянок гіпестезії коливалась від 10 до 50 см2, середня площа становила 32,50 ± 15,28 см2. Середній бал за опитувальником із центральної сенситизації становив 46,80 ± 17,79, що відповідало вираженому рівню центральної сенситизації. Середній бал за опитувальником painDETECT становив 20,20 ± 2,38. Середній бал за HADS за субшкалою тривоги у групі дорівнював 12,40 ± 6,00, що відповідало клінічно вираженій тривозі; за субшкалою депресії — 9,80 ± 1,77, що відповідало субклінічній депресії. Стан здоров’я за шкалою EuroQol-5D становив 3,60 ± 2,01 бала. Середній бал за опитувальником катастрофізації болю становив 29,00 ± 12,99. Початкова характеристика групи пацієнтів наведена в табл. 2.
/16.jpg)
На фоні лікування інтенсивність болю за ВАШ знизилась з 6,60 ± 1,54 бала до 6,00 ± 1,17 бала на 14-й день, до 5,90 ± 1,41 бала на 28-й день та статистично вірогідно до 4,80 ± 1,01 бала та 4,70 ± 1,03 бала на 42-й та 56-й дні відповідно. Динаміка показників інтенсивності болю за ВАШ наведена на рис. 1.
На фоні лікування також зменшилась кількість пацієнтів із зонами алодинії з 16 осіб в 1-й день до 14 на 14-й день, до 9 на 28-й день, до 7 на 42-й день та до 5 на 56-й день. Динаміка кількості пацієнтів з алодинією наведена на рис. 2. Середня площа зони алодинії зменшувалась таким чином: 19,25 ± 18,38 см2 в 1-й день, 19,07 ± 16,25 см2 на 14-й день; з 28-го дня вірогідно до 10,11 ± 3,86 см2, до 10,20 ± 5,26 см2 на 42-й день та до 10,11 ± 3,86 см2 на 56-й день. Динаміка показників середньої площі алодинії наведена на рис. 3.
Кількість пацієнтів із зонами гіпестезії на фоні лікування зменшилась з 16 осіб в 1-й та 14-й дні до 12 на 28-й день та до 8 на 42-й і 56-й дні. Динаміка кількості пацієнтів з гіпестезією наведена на рис. 4. Середня площа зони гіпестезії вірогідно зменшувалась таким чином: 32,50 ± 15,28 см2 в 1-й день, 26,75 ± 13,85 см2 на 14-й день, 12,83 ± 4,39 см2 на 28-й день, 12,13 ± 2,47 см2 на 42-й день та 9,25 ± 1,04 см2 на 56-й день. Динаміка показників середньої площі гіпестезії наведена на рис. 5.
У групі пацієнтів на фоні лікування відмічалось виражене зменшення балів за опитувальником із центральної сенситизації, яке було вірогідним з 42-го дня і відповідало легкому ступеню сенситизації. Так, у 1-й день середній бал за опитувальником із центральної сенситизації був на рівні 46,80 ± 17,79, на 14-й день — 42,40 ± 7,53, на 28-й день — 40,60 ± 13,10, на 42-й день — 36,80 ± 15,63, на 56-й день — 36,20 ± 15,28. Динаміка балів за опитувальником із центральної сенситизації наведена на рис. 6.
Привертає увагу вірогідне і швидке зниження невропатичних проявів за опитувальником painDETECT, яке відмічалось з 14-го дня лікування і далі. Так, у 1-й день бал за опитувальником painDETECT становив 20,20 ± 2,38, на 14-й день — 16,20 ± 1,51, на 28-й день — 16,40 ± 3,02, на 42-й день — 16,00 ± 3,95, на 56-й день — 16,10 ± 3,21. Динаміка невропатичних проявів за опитувальником painDETECT наведена на рис. 7.
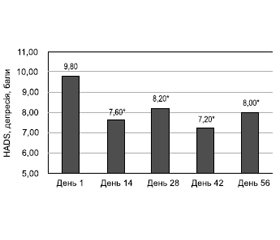
На фоні лікування спостерігалось статистично вірогідне зниження тривоги і депресії за HADS вже з 14-го дня. Так, середній бал за субшкалою тривоги в 1-й день становив 12,40 ± 6,00, на 14-й день — 10,60 ± 4,92, на 28-й день — 9,80 ± 5,44, на 42-й день — 8,60 ± 4,38, на 56-й день — 8,80 ± 5,29. За субшкалою депресії середній бал в 1-й день становив 9,80 ± 1,77, на 14-й день — 7,60 ± 3,82, на 28-й день — 8,20 ± 2,12, на 42-й день — 7,20 ± 2,86, на 56-й день — 8,00 ± 3,81. Динаміка тривоги і депресії за HADS наведена на рис. 8 та 9 відповідно.
Стан здоров’я за шкалою EuroQol-5D вірогідно покращився більше ніж у 1,5 раза вже з 14-го дня лікування. Так, у 1-й день стан здоров’я за шкалою EuroQol-5D становив 3,60 ± 2,01 бала, на 14-й день — 5,00 ± 2,51, на 28-й день — 4,80 ± 2,28, на 42-й день — 5,60 ± 0,82, на 56-й день — 5,00 ± 2,25. Динаміка стану здоров’я за шкалою EuroQol-5D наведена на рис. 10.
На фоні лікування зменшувався бал за шкалою катастрофізації болю. Так, у 1-й день показник становив 29,00 ± 12,99 бала, на 14-й день — 24,00 ± 13,31, на 28-й день — 24,20 ± 13,07, на 42-й день — 23,80 ± 10,69, на 56-й день — 22,00 ± 10,20. Динаміка за шкалою катастрофізації болю наведена на рис. 11.
Під час лікування відмічалось вірогідне зростання суб’єктивної задоволеності пацієнта лікуванням з 5,00 ± ± 2,34 бала в 1-й день до 6,80 ± 1,36 бала на 14-й день, до 6,80 ± 1,99 бала на 28-й день, до 6,60 ± 1,79 бала на 42-й день, до 7,40 ± 1,79 бала на 56-й день. Динаміка задоволеності пацієнта лікуванням наведена на рис. 12.
При проведенні ЕНМГ нижніх кінцівок з визначенням ШПЗ по моторних волокнах були виявлені численні зміни показників без чіткої динаміки. Статистично вірогідні позитивні зміни були зафіксовані тільки при дослідженні nervus tibialis з musculus аbductor hallucis.
ЕНМГ-динаміка ШПЗ по моторних волокнах нижніх кінцівок на фоні лікування наведена в табл. 3 та на рис. 13–16.
При проведенні ЕНМГ нижніх кінцівок з визначенням ШПЗ по сенсорних волокнах (nervus рeroneus superficialis та nervus suralis) відмічалась статистично вірогідна позитивна динаміка показників амплітуди та швидкості.
ЕНМГ-динаміка ШПЗ по сенсорних волокнах нижніх кінцівок на фоні лікування наведена в табл. 4 та на рис. 17–20.
Обговорення
У цьому спостереженні група пацієнтів характеризувалась високою інтенсивністю болю за ВАШ, високою частотою представленості таких сенсорних феноменів, як алодинія і гіпестезія. У результаті тривалого перебігу захворювання у пацієнтів сформувались виражені невропатичні зміни, які характеризувались високими балами за опитувальником painDETECT, а також наявністю зон алодинії і гіпестезії. Тривалий і виражений невропатичний біль, ймовірно, призвів до формування цілої низки патологічних процесів у центральній нервовій системі, які проявлялись високими балами за опитувальником із центральної сенситизації, опитувальником катастрофізації болю, госпітальною шкалою тривоги і депресії. У той же час загальний стан здоров’я за шкалою EuroQol-5D оцінювався пацієнтами як незадовільний, а загальна задоволеність лікуванням була невисокою. За даними ЕНМГ відмічалось зниження майже всіх показників.
/20_2.jpg)
На фоні лікування Мієлофаном протягом 56 днів (8 тижнів) відмічалась позитивна динаміка клінічної й електронейрофізіологічної картини. Так, інтенсивність болю за ВАШ почала знижуватись вже з 14-го дня, що було статистично вірогідно з 42-го дня, а на 56-й день відмічалось майже 30-відсоткове зниження порівняно з 1-м днем. Кількість пацієнтів з алодинією на фоні лікування зменшилась приблизно в 3 рази, а середня площа алодинії — майже в 2 рази. Кількість пацієнтів з гіпестезією зменшилась в 2 рази, а її середня площа — більше ніж в 3 рази. Вираженість невропатичного компонента болю, за даними опитувальника painDETECT, на фоні лікування зменшилась приблизно на 20 %. Подібне зниження відбувалось за шкалою катастрофізації болю. Тривожні й депресивні прояви, за даними госпітальної шкали тривоги і депресії, на фоні лікування також знижувались, що було вірогідно вже з 14-го дня терапії. Бал за опитувальником із центральної сенситизації мав тенденцію до зниження вже з 14-го дня, а на 42-й і 56-й дні це зниження було статистично вірогідним, приблизно становило 20 % і відповідало легкому ступеню сенситизації. Загальний стан здоров’я, за даними опитувальника EuroQol-5D, статистично вірогідно покращився майже на 40 % вже з 14-го дня. Задоволеність лікуванням зросла більше ніж на 30 % вже на 14-й день, що було статистично вірогідно і на 56-й день становило майже 50 %.
/21.jpg)
Аналізуючи зміни показників амплітуди і швидкості поширення збудження за даними ЕНМГ нижніх кінцівок, можна відмітити незначні зміни в показниках з моторних волокон (nervus tibialis з musculus аbductor hallucis та nervus рeroneus з musculus еxtensor digitorum brevis). Водночас при аналізі змін показників амплітуди і швидкості поширення збудження по сенсорних волокнах відмічались певні тенденції, які були статистично вірогідними. Так, на фоні лікування амплітуда nervus рeroneus superficialis зліва і справа почала вірогідно підвищуватись вже з 14-го дня, а на 56-й день зросла більше ніж у 2 рази порівняно з 1-м днем. Швидкість поширення збудження по nervus рeroneus superficialis справа мала тенденцію до зростання, яка не була статистично вірогідною. Зліва швидкість поширення збудження по nervus рeroneus superficialis вже на 14-й день вірогідно збільшилась приблизно на 60 %, а на 56-й день — більше ніж удвічі. Амплітуда nervus suralis справа мала тенденцію до збільшення, тоді як зліва вірогідно збільшилась приблизно вдвічі вже на 14-й день. Швидкість поширення збудження по nervus suralis справа вірогідно збільшилась майже на 50 % з 42-го дня, зліва — вірогідно на 40 % з 14-го дня. Різниця між показниками зліва і справа може бути обумовлена початково різним ступенем ураження кінцівок діабетичною невропатією.
Висновки
Пацієнти з діабетичною невропатією характеризуються високою інтенсивністю больового синдрому, наявністю зон алодинії та гіпестезії, високими балами за опитувальниками painDETECT, із центральної сенситизації, катастрофізації болю, госпітальною шкалою тривоги і депресії, низькою оцінкою стану здоров’я за шкалою EuroQol-5D та невисокою задоволеністю лікуванням, зниженими показниками амплітуди і швидкості поширення збудження по моторних і сенсорних нервових волокнах нижніх кінцівок.
На фоні прийому Мієлофану протягом 56 днів відмічалось зниження інтенсивності болю за ВАШ, зменшення алодинії, гіпестезії та невропатичних проявів за опитувальником painDETECT, зменшення центральної сенситизації, катастрофізації болю, тривоги та депресії, покращення стану здоров’я та задоволеності лікуванням, зростання певних електронейрофізіологічних показників, зокрема покращення провідності по сенсорних волокнах нервів нижніх кінцівок.
Необхідне проведення додаткових досліджень з метою вивчення впливу додаткових елементів терапії на стан пацієнтів.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Отримано/Received 10.08.2022
Рецензовано/Revised 21.08.2022
Прийнято до друку/Accepted 02.09.2022
/16.jpg)

/15.jpg)
/17.jpg)
/18.jpg)
/18_2.jpg)
/19.jpg)
/20.jpg)
/20_2.jpg)
/21.jpg)