Международный неврологический журнал Том 18, №8, 2022
Вернуться к номеру
Гліобластома: огляд літератури
Авторы: Dipak Chaulagain, V. Smolanka, A. Smolanka, T. Havryliv
Uzhhorod Regional Clinical Center of Neurosurgery and Neurology, Uzhhorod National University, Uzhhorod, Ukraine
Рубрики: Неврология
Разделы: Справочник специалиста
Версия для печати
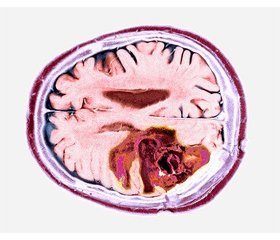
Гліобластома є найбільш агресивним типом пухлини головного мозку, визначена як астроцитома 4-го типу відповідно до 5-го видання класифікації пухлин центральної нервової системи Всесвітньої організації охорони здоров’я. Це рак, що починається в гліальних клітинах, які є підтримуючими клітинами мозку. Гліобластома є рідкісним типом пухлини головного мозку і становить близько 15 % усіх цих пухлин. Найчастіше вона зустрічається в дорослих віком понад 50 років, причому в чоловіків розвивається частіше, ніж у жінок. Симптоми гліобластоми можуть відрізнятися залежно від локалізації пухлини в головному мозку. Загальні симптоми включають головний біль, нудоту, блювання та зміни зору. Іншими симптомами можуть бути судоми, зміни в поведінці або особистості, а також труднощі з мовою або рухами. Стандартом лікування гліобластоми є поєднання хірургічного втручання, променевої та хіміотерапії. Хірургічне втручання є першим кроком у лікуванні, метою якого є видалення якомога більшої частини пухлини. Променева та хіміотерапія зазвичай використовуються для знищення будь-яких залишкових ракових клітин. Однак, незважаючи на ці методи лікування, прогноз при гліобластомі, як правило, поганий, більшість пацієнтів живуть менше двох років після встановлення діагнозу. Загалом гліобластома є дуже агресивною пухлиною головного мозку з поганим прогнозом. Стандартне лікування передбачає поєднання хірургічного втручання, променевої та хіміотерапії. Останні дослідження були зосереджені на розробці нових методів лікування, таких як цільова терапія та імунотерапія, що показали обнадійливі результати в клінічних випробуваннях.
Glioblastoma is the most aggressive type of brain tumor classified as type 4 astrocytoma according to 5th edition of the World Health Organization сlassification of tumors of the central nervous system. It is a cancer that begins in the glial cells, which are the supporting cells of the brain. Glioblastoma is a rare type of brain tumor and accounts for about 15 % of all brain tumors. It is most commonly found in adults over the age of 50, and men are more likely to develop it than women. The symptoms of glioblastoma can vary depending on the location of the tumor in the brain. Common symptoms include headaches, nausea, vomiting, and changes in vision. Other symptoms can include seizures, changes in behavior or personality, and difficulty with speech or movement. The standard treatment for glioblastoma is a combination of surgery, radiation therapy, and chemotherapy. Surgery is usually the first step in treatment, with the goal of removing as much of the tumor as possible. Radiation therapy and chemotherapy are typically used to kill any remaining cancer cells. However, despite these treatments, the prognosis for glioblastoma is generally poor, with most patients surviving for less than two years after diagnosis. Overall, glioblastoma is a highly aggressive brain tumor with poor prognosis. The standard treatment is a combination of surgery, radiation therapy and chemotherapy. Recent research has focused on developing new treatments, such as targeted therapies and immunotherapies, which have shown promising results in clinical trials.
гліобластома; гліома; астроцитома
glioblastoma; glioma; astrocytoma