Международный неврологический журнал Том 19, №1, 2023
Вернуться к номеру
Вплив обсягу резекції на віддалені хірургічні результати при дифузній астроцитомі II ступеня: ретроспективне дослідження
Авторы: Dipak Chaulagain, V. Smolanka, A. Smolanka, T. Havryliv
Uzhhorod Regional Clinical Center of Neurosurgery and Neurology, Uzhhorod National University,
Uzhhorod, Ukraine
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
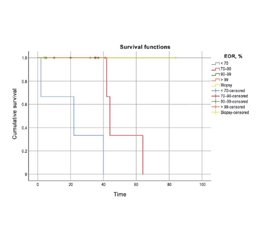
Актуальність. Дифузні астроцитоми (ДА) — це повільно зростаючі первинні дифузні пухлини головного мозку, що походять з гліальних клітин. У складі гліоми низького ступеня злоякісності ДА II ступеня є пухлиною з нечіткими межами; невеликі скупчення пухлинних клітин мають тенденцію поширюватися в прилеглі здорові тканини та проникати в них. Основні дебати точаться навколо прогностичного значення обсягу резекції (ОР) при ДА. Щоб оцінити вплив ОР на результати хірургічного втручання при ДА II ступеня в довгостроковій перспективі, ми провели ретроспективний аналіз. Зокрема, метою було оцінити кореляцію між до- та післяопераційними розмірами пухлини та загальною виживаністю (ЗВ). Матеріали та методи. Пацієнти з діагнозом дифузної астроцитоми, установленим між 2010 і 2020 роками, які перенесли операцію з видалення пухлини, а потім знаходилися під спостереженням до січня 2022 року, були включені в наш ретроспективний огляд. ОР визначали як передопераційний об’єм мінус післяопераційний об’єм, поділений на передопераційний об’єм, помножений на 100 %, а потім класифікували в п’ять груп на основі результатів магнітно-резонансної томографії, отриманих через 72 години після втручання. Існує п’ять категорій: 1) > 99 % — тотальна резекція; 2) 91–99 % — майже тотальна резекція; 3) 70–90 % — субтотальна резекція; 4) 70 % — часткова резекція; 5) біопсія. Незалежний зв’язок між ОР та наступною ЗВ аналізували за допомогою багатовимірної регресійної моделі пропорційних ризиків. Результати. Зрештою, ми включили до нашого дослідження 18 випадків. Усі пацієнти мали середню виживаність 35,33 місяця: 38 місяців у чоловіків (n = 12, середній вік 40,83 року) і 22 місяці в жінок (n = 6, середній вік 32 роки). Ми розділили спостережувані періоди виживання пацієнтів на п’ять різних класів на основі ОР. Виявлено, що вищий показник ОР передбачає кращий прогноз у дорослих осіб із дифузною астроцитомою. Не було статистично значущої кореляції між до- або післяопераційним об’ємом пухлини та ЗВ, як визначено регресійним аналізом. Висновки. Вищий показник ОР вказує на кращий прогноз у пацієнтів із дифузною астроцитомою. Наші результати підтверджують необхідність переоцінкі хірургічної ефективності при дифузній астроцитомі та підтримують використання максимальної резекції як початкового методу лікування. Виживаність пацієнтів, напевно, не залежить від розміру видаленої пухлини.
Background. Diffuse astrocytomas (DAs) are slow-growing, primary, diffuse brain tumors that originate from glial cells. As part of low-grade glioma, grade II DA is a tumor with unclear borders; small clusters of tumor cells tend to expand into and infiltrate adjacent healthy tissue. Major debate surrounds the predictive value of the extent of resection (EOR) in DA. To evaluate the impact of the EOR on the surgical outcomes in grade II DA over the long-term, we conducted a retrospective analysis. Specifically, we aimed to evaluate the correlation between pre- and postoperative tumor sizes and overall survival (OS). Materials and methods. Patients diagnosed with diffuse astrocytoma between 2010 and 2020 who underwent surgery to remove the tumor and were then monitored until January 2022 were included in our retrospective review. The EOR was determined as preoperative volume minus postoperative volume divided by preoperative volume multiplied by 100 %, and then categorized into five groups based on magnetic resonance imaging obtained 72 hours following surgery. There are five categories: 1) > 99 % — gross total resection; 2) 91–99 % — near-total resection; 3) 70–90 % — subtotal resection; 4) 70 % — partial resection; 5) biopsy. The independent relationship between the EOR and subsequent OS was analyzed using a multivariate proportional hazards regression model. Results. In the end, we included 18 cases in our investigation. All patients had a mean survival of 35.33 months, 38 months in males (n = 12, mean age 40.83 years) and 22 months in females (n = 6, mean age 32 years). We divided the observed patient survival periods into five distinct classes based on the EOR. We found that a higher EOR predicts a better prognosis for adult individuals with diffuse astrocytoma. There was no statistically significant correlation between the pre- or postoperative tumor volume and the OS, as determined by regression analysis. Conclusions. Greater EOR is indicative of a better prognosis for patients with diffuse astrocytoma. Our results provide a much-needed re-evaluation of surgical efficacy in diffuse astrocytoma and support the use of maximal resection as initial treatment. Patient survival does not seem to be related to the size of the removed tumor.
гліома; дифузна астроцитома; астроцитома; обсяг резекції
glioma; diffuse astrocytoma; astrocytoma; extent of resection