Международный неврологический журнал Том 19, №1, 2023
Вернуться к номеру
Неврологічне й функціональне відновлення після інсульту при лікуванні в інтегрованому інсультному блоці в Україні
Авторы: Фломін Ю.В.
Медичний центр «Універсальна клініка «Оберіг», м. Київ, Україна
Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
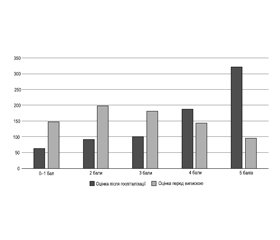
Актуальність. Якісна медична допомога сприяє поліпшенню результатів лікування мозкового інсульту (МІ), але оптимальна модель стаціонарного лікування поки не визначена. Мета дослідження: оцінити динаміку неврологічного дефіциту та функціональної спроможності пацієнтів з МІ протягом їх стаціонарного лікування в інтегрованому інсультному блоці (ІІБ) у різні періоди захворювання. Матеріали та методи. Зібраний і проаналізований набір даних пацієнтів з інтрапаренхіматозними МІ, які були госпіталізовані в ІІБ у 2010–2018 рр. у різні періоди захворювання. Усі МІ за типом поділені на внутрішньомозковий крововилив та ішемічний мозковий інсульт (ІМІ). Тяжкість МІ оцінювали за National Institutes of Health Stroke Scale (NIHSS), базову щоденну активність — за індексом Бартел, повсякденну життєдіяльність — за модифікованою шкалою Ренкіна (мШР). Якісні змінні виражені через частоту й відсотки, кількісні змінні — як медіана і міжквартильний інтервал (МКІ). Статистичний аналіз проводився в пакеті MedCalc®. Результати. У дослідження були включені 852 пацієнти (42,7 % жінок, 80,9 % ІМІ) віком від 20 до 95 років (медіана 66,7 року, МКІ 57,7–75,0), з яких 168 (19,7 %) були госпіталізовані протягом найгострішого (0–24 години), 165 (19,4 %) — гострого (1–7 діб), 288 (33,8 %) — раннього підгострого (8–90 днів), 86 (10,1 %) — пізнього підгострого (91–180 днів) і 146 (17,2 %) — віддаленого періоду (пізніше за 180 днів) МІ. Оцінка за NIHSS після госпіталізації варіювала від 1 до 39 балів (медіана 11 балів, МКІ 6–18). Після стаціонарного лікування вдвічі (з 22,4 до 43,1 %) збільшилась частка легких (NIHSS = 0–5 балів) МІ і більше ніж удвічі (з 36,9 до 16,9 %) зменшилась частка тяжких або дуже тяжких МІ (NIHSS ≥ 14 балів). У 169 (70,7 %) із 239 пацієнтів, які надійшли в найгострішому або гострому періоді, оцінка за індексом Бартел перед випискою була 75–100 балів. За мШР 68 (8,0 %) пацієнтів мали початкову оцінку 0–1 бал, 95 (11,1 %) — 2 бали, 109 (12,8 %) — 3 бали, 223 (26,2 %) — 4 бали і 357 (41,9 %) — 5 балів. Перед випискою більше ніж удвічі (з 20,1 до 45,1 %) зросла частка пацієнтів, які досягли рівня незалежності від сторонньої допомоги (мШР = 0–2 бали), і більше ніж удвічі (з 66,6 до 31,1 %) зменшилась частка пацієнтів з тяжкими обмеженнями життєдіяльності (мШР = 4–5 балів). Медіана оцінок за мШР значуще (p < 0,05) зменшилась в усіх періодах МІ як у пацієнтів з ІМІ, так і в пацієнтів з внутрішньомозковим крововиливом. У 184 (71,3 %) з 258 пацієнтів, які були госпіталізовані в найгострішому або гострому періоді МІ, досягнутий сприятливий функціональний результат лікування (мШР = 0–3 бали). Висновки. Результати лікування у вітчизняному ІІБ свідчать про суттєве неврологічне й функціональне відновлення пацієнтів з МІ і відповідають показникам у країнах з високим рівнем доходів.
Background. High-quality medical care can improve cerebral stroke (CS) outcomes, but the optimal model of in-patient care has not been determined. We aimed to evaluate changes in neurological impairment and functional limitations of CS in patients during their stay in a comprehensive stroke unit in different stroke phases. Materials and methods. The dataset of patients with intraparenchymal CS who were admitted to a comprehensive stroke unit in 2010 to 2018 with different stroke phases was collected and analyzed. By type, all CSs were divided into intracerebral hemorrhage or ischemic cerebral stroke (ICS). Stroke severity was assessed with the National Institutes of Health Stroke Scale (NIHSS), activities of daily living with Barthel index, and disability with modified Rankin scale (mRS). Qualitative variables are expressed by frequency and percentages, quantitative variables by median and interquartile range (IQR). Statistical analysis was performed in the MedCalc®. Results. The study enrolled 852 patients (42.7 % women, 80.9 % ICS) aged 20 to 95 years (median 66.7 years, IQR 57.7–75.0), of whom 168 (19.7 %) were hospitalized in hyperacute (0–24 hours), 165 (19.4 %) in acute (1–7 days), 288 (33.8 %) in early subacute (8–90 days), 86 (10.1 %) in late subacute (91–180 days), and 146 (17.2 %) in chronic (180+ days) stroke phase. The baseline NIHSS score varied from 1 to 39 (median 11 points, IQR 6–18). At discharge, the proportion of mild (NIHSS = 0–5) CS doubled (22.4 vs. 43.1 %), and the proportion of severe or very severe CS (NIHSS ≥ 14 points) decreased more than twice (36.9 vs. 16.9 %). In 169 (70.7 %) of 239 patients admitted in hyperacute or acute phase, final Barthel index was 75–100 points. Baseline mRS score in 68 (8.0 %) of patients was 0–1, while 95 (11.1 %) participants had 2, 109 (12.8 %) had 3, 223 (26.2 %) had 4, and 357 (41.9 %) had 5 points. At discharge, the share of patients who regained independence (mRS = 0–2) more than doubled (20.1 vs. 45.1 %) and the proportion of patients with severe disability (mRS = 4–5) decreased more than twice (66.6 vs. 31.1 %). Median mRS scores significantly (p < 0.05) decreased in all stroke phases both in ICS and intracerebral hemorrhage patients. In 184 (71.3 %) of 258 patients admitted in hyperacute or acute phase, a favorable functional outcome (mRS = 0–3) was achieved. Conclusions. Treatment outcomes in CS patients admitted to a comprehensive stroke unit in Ukraine indicate a significant degree of neurological and functional recovery comparable with findings in high-income countries.
ішемічний мозковий інсульт; внутрішньомозковий крововилив; інтегрований інсультний блок; індекс Бартел; модифікована шкала Ренкіна; неврологічне відновлення; функціональне відновлення
ischemic cerebral stroke; intracerebral hemorrhage; comprehensive stroke unit; Barthel index; modified Rankin scale; neurological recovery; functional recovery