Международный неврологический журнал Том 19, №4, 2023
Вернуться к номеру
Зміни числа макрофагів, Т-лімфоцитів, активності антиоксидантних ферментів у головному мозку, поведінки і структури нейронів центральної нервової системи у дорослих і старіючих мишей різних ліній із МФТП-індукованою моделлю паркінсонізму
Авторы: Лабунець І.Ф., Пантелеймонова Т.М., Утко Н.О., Кирик В.М., Савосько С.І., Літошенко З.Л.
Інститут генетичної та регенеративної медицини ДУ «Національний науковий центр «Інститут кардіології, клінічної та регенеративної медицини імені академіка М.Д. Стражеска НАМН України»,
м. Київ, Україна
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
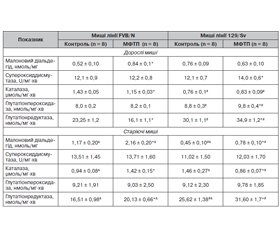
Актуальність. Для розвитку морфофункціональних порушень нервової системи при хворобі Паркінсона (ХП) мають значення продукти окисного стресу і клітин імунної системи (Т-лімфоцити, макрофаги). Показано також зв’язок ХП із віком та функціонуванням генів головного комплексу гістосумісності. Мета: оцінити зміни вмісту в головному мозку Т-лімфоцитів, макрофагів, малонового діальдегіду (МДА), активності антиоксидантних ферментів, структури нейронів головного та спинного мозку, а також поведінки дорослих і старіючих мишей із різним гаплотипом за системою Н-2 з токсичною моделлю паркінсонізму. Матеріали та методи. Дорослим і старіючим мишам-самицям лінії FVB/N (генотип H-2q) і 129/Sv (генотип Н-2b) вводили нейротоксин 1-метил-4-феніл-1,2,3,6-тетрагідропіридин (МФТП) у дозі 30 мг/кг 1 раз. У головному мозку оцінювали вміст СD3+, СD3–CD11b+ і CD3+CD11b+ клітин, МДА та активність антиоксидантних ферментів; досліджували структуру нейронів чорної субстанції головного мозку, поперекового відділу спинного мозку та поведінку в тестах «відкрите поле», на ригідність і у ротарод-тесті (rotarod test). Результати. У дорослих мишей обох ліній під впливом МФТП порушується моторна і немоторна (орієнтовно-дослідницька, емоційна) активність; при цьому лінійні відмінності змін поведінки виявляються у їх напрямку та вираженості. У старіючих дослідних мишей лінії FVB/N переважають моторні порушення поведінки, які у мишей лінії 129/Sv поєднуються з немоторними змінами. Порушення структури нейронів чорної субстанції після введення МФТП більш виражене у мишей лінії FVB/N, а нейронів поперекового відділу спинного мозку — у мишей лінії 129/Sv. У старіючих дослідних мишей обох ліній відсоток ушкоджених нейронів у головному і спинному мозку суттєво менший, ніж у дорослих тварин. Після введення МФТП дорослим мишам спрямованість змін вмісту Т-лімфоцитів і макрофагів у головному мозку (підвищення або зниження) залежить від їх лінії. У старіючих дослідних мишей лінійна різноспрямованість змін зберігається для вмісту Т-лімфоцитів, тоді як уміст макрофагів зростає незалежно від лінії тварин. Під впливом МФТП уміст МДА зростає у головному мозку мишей усіх експериментальних груп; напрям змін активності супероксиддисмутази, каталази, глутатіонпероксидази та глутатіонредуктази (зменшення або зростання) залежить від лінії тварин та їх віку. Висновки. МФТП-індуковані зміни (напрямки, вираженість) вмісту в головному мозку Т-лімфоцитів, макрофагів, активності антиоксидантних ферментів, структури нейронів чорної субстанції і поперекового відділу спинного мозку, а також поведінкових реакцій значною мірою залежать від гаплотипу дорослих мишей за системою Н-2. Існують вікові особливості впливу нейротоксину на зміни досліджуваних показників у мишей різних ліній; при цьому залежність змін більшості з них від H-2 гаплотипу зберігається.
Background. Oxidative stress and immune cell (T-lymphocytes, macrophages) products are important for the development of morpho-functional disorders of the nervous system in Parkinson’s disease. Connection of Parkinson’s disease with age and functioning of the major histocompatibility complex genes are also shown. The purpose was to assess changes in the brain of T-lymphocytes, macrophages, malondialdehyde (MDA) contents, the activity of antioxidant enzymes, the structure of brain and spinal cord neurons, as well as behavior in adult and aging mice with different H-2 haplotypes and toxic model of parkinsonism. Materials and methods. Adult and aging female mice of FVB/N (genotype H-2q) and 129/Sv (genotype H-2b) strains were once injected with the neurotoxin 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine (MPTP) at the dose of 30 mg/kg. Contents of CD3+, CD3–CD11b+, CD3+CD11b+ cells, MDA and the activity of antioxidant enzymes in the brain were evaluated. The structure of neurons of the substantia nigra, lumbar spine, behavior in the open field test, as well as in rigidity and rotarod performance tests were studied. Results. In adult mice of both strains, motor and non-motor (spatial-exploratory, emotional) activity is impaired under the influence of MPTP. At the same time, linear differences in behavior changes were revealed in their directions and expressiveness. In aging FVB/N experimental mice, motor behavior disorders prevailed and were combined with non-motor changes in 129/Sv mice. Violations in the structure of substantia nigra neurons after MPTP administration were more severe in FVB/N mice while those in the lumbar spinal cord neurons were more pronounced in the 129/Sv mice. In aging experimental mice of both strains, the percentage of damaged neurons in the brain and spinal cord was significantly lower than in adult animals. After MPTP administration to adult mice, the direction of changes in the brain T-lymphocytes and macrophages (increase or decrease) depended on their strains. In aging experimental mice, the linear heterogeneity of changes was preserved for the T-lymphocyte content, while the macrophage level was increased regardless of the animal strains. Under MPTP influence, the MDA content increased in the brain of mice of all experimental groups. The direction of changes in superoxide dismutase, catalase, glutathione peroxidase and glutathione reductase activities (decrease or increase) depended on the strains of animals and their age. Conclusions. MPTP-induced changes (directions, expressiveness) in T-lymphocyte, macrophage contents, antioxidant enzymes activity, the structure of neurons of the substantia nigra and lumbar spine, as well as behavioral reactions largely depended on the adult mice H-2 haplotype. There were age-related effects of the neurotoxin on changes in the studied indicators in mice of different strains. At the same time, dependence of changes in most above indicators on the H-2 haplotype preserved.
нейротоксин МФТП; паркінсонізм; вік; Т-лімфоцити, макрофаги і антиоксидантні ферменти головного мозку; нейрони чорної субстанції та спинного мозку; поведінкові реакції
MPTP neurotoxin; parkinsonism; age; brain T-lymphocytes, macrophages and antioxidant enzymes; neurons of the substantia nigra and spinal cord; behavioral reactions