Вступ
На сьогодні на цукровий діабет (ЦД) у світі хворіє 500 млн осіб, проте дослідники вважають, що кількість хворих на цукровий діабет до 2050 року може збільшитися до 1,3 млрд осіб [1]. Діабетична полінейропатія є одним з найчастіших ускладнень при цукровому діабеті і поряд з ангіопатією призводить до розвитку діабетичної стопи, а в подальшому — і до ампутації кінцівок.
Незважаючи на те, що ключовою причиною розвитку діабетичних ускладнень при цукровому діабеті є гіперглікемія, навіть жорсткий контроль глікемії в пацієнтів із ЦД 2-го типу не зупиняє прогресування полінейропатії [2].
Дослідження показують, що в розвитку діабетичної полінейропатії важливу роль відіграють прозапальні цитокіни, такі як С-реактивний протеїн, фактор некрозу пухлини альфа (TNF-α) та інтерлейкін-6 [3, 4].
У проведених дослідженнях підтверджується зростання рівня TNF-α в пацієнтів з діабетичною полінейропатією порівняно з контрольною групою [5–7]. Також є дані літератури, які вказують, що в пацієнтів з больовою формою діабетичної полінейропатії вищий рівень TNF-α, ніж у пацієнтів без болю [7].
У 2016 році опубліковано метааналіз, у який було включено 14 досліджень (2650 учасників). Він показав, що: 1) рівень TNF-α вищий у пацієнтів з діабетичною полінейропатією, ніж у пацієнтів із ЦД 2-го типу без діабетичної полінейропатії; 2) рівень TNF-α вищий у пацієнтів з діабетичною полінейропатією, ніж у здорової когорти; 3) рівень TNF-α вищий у пацієнтів з больовою формою діабетичної полінейропатії порівняно з пацієнтами з безбольовою формою діабетичної полінейропатії [9].
У дослідах на щурах показано, що інгібування TNF-α приводить до значного поліпшення симптоматики [10].
У дослідженнях В. Nádró et al. встановлено позитивний кореляційний зв’язок між впливом альфа-ліпоєвої кислоти на TNF-α і поліпшенням порогу чутливості [11].
Останнім часом дослідники все більше приділяють увагу впливу жирних кислот (ЖК) на нервову систему. Вміст ліпідів у мієліні становить 70 %. Особливістю хімічного складу нервової тканини є переважання складних полярних ліпідів (сфінголіпідів, гліколіпідів, фосфоліпідів) і холестерину при незначному вмісті тригліцеридів. Така композиція пояснюється спеціальними функціями, пов’язаними з генерацією нейронного потенціалу, проведенням імпульсу та його синаптичною передачею. Іншою особливістю хімічного складу є те, що, окрім стеаринової, олеїнової та ліноленової (С18 жирні кислоти), до складу сфінгомієліну і цереброзиду входять лігноцеринова, церебронова і нервонова жирні кислоти [12].
На окрему увагу заслуговує нервонова кислота, яка у великій кількості є в організмі людини. Нервонова кислота не лише функціонує у вільній формі, але й бере участь у багатьох біологічних процесах, таких як утворення клітинної мембрани і нейротрансмісія. Останні численні дослідження доводять, що добавки нервонової кислоти не лише корисні для здоров’я, але й можуть поліпшити перебіг багатьох захворювань, таких як неврологічні захворювання, цукровий діабет і навіть онкологічні захворювання. Нервонова кислота та її сфінгомієліни є спеціальним матеріалом для мієлінізації в немовлят і ремієлінізації у хворих на розсіяний склероз. Крім того, в останніх дослідженнях повідомляється, що введення нервонової кислоти зменшує моторні розлади в мишей із хворобою Паркінсона й обмежує в них збільшення ваги. Порушення обміну й кількості нервонової кислоти та її сфінголіпідів можуть призвести до розвитку багатьох захворювань, і розуміння цих механізмів має вирішальне значення для дослідження потенційних терапевтичних підходів до таких захворювань [13].
Нервонова кислота є найважливішою жирною кислотою в нервовій системі. Це основна довголанцюгова ненасичена ЖК у розгалуженому ланцюзі ліпідів, таких як фосфатидилхолін, сфінгомієлін і церамід, і синтез нервонової кислоти (C24:1ω-9) є найважливішим у ліпідному гомеостазі мієлінової оболонки. Нервові волокна складаються в основному з мієлінової оболонки та аксонів, причому мієлінова оболонка оточена товстим ліпідним шаром, який визначає швидкість проведення нервового імпульсу. Для регенерації зовнішньої ліпідної мембрани мієлінової оболонки потрібні різні ліпіди зовнішньої мембрани як сировина. Тому нервонова кислота (C24:1ω-9) розглядається як одна з найважливіших структурних сполук у нервовій системі [14].
Нейротропний ефект вітамінів групи В та альфа-ліпоєвої кислоти доведений давно і широко використовується при лікуванні багатьох нозологій. Вітаміни групи В та альфа-ліпоєва кислота впливають на метаболізм білків, жирів і вуглеводів, а також вони необхідні для функціонування нервової системи. Відомо, що додатковий прийом вітамінів групи В зменшує больовий синдром у пацієнтів, а одночасний прийом з НПЗП дозволяє зменшити дозу й тривалість прийому останніх.
Ланейра містить у складі нервонову кислоту, що сприяє регенерації мієлінових оболонок, відновлює пошкоджені нервові волокна, усуває блокування передачі нервового імпульсу. Ацетил L-карнітин, що відновлює проведення нервового імпульсу, поліпшує метаболізм периферичних нервів і клітинний обмін. А також Ланейра містить альфа-ліпоєву кислоту, що знижує больові відчуття, підвищує чутливість кінцівок і забезпечує ангіопротекцію, і вітаміни групи В, селен і цинк, що надають аналгетичну дію, підвищують швидкість проведення збудження по нервових волокнах й стабілізують клітинні мембрани.
Тому можливим напрямком подальших досліджень може бути вивчення особливостей роботи периферичної нервової системи в дорослих і визначення зміни рівня основних маркерів електронейроміографічних (ЕНМГ) показників під впливом тривалого застосування комбінованих препаратів, що містять альфа-ліпоєву кислоту, вітаміни групи В і нервонову кислоту. Отримані результати вивчення дозволять удосконалити заходи щодо лікування і розробити алгоритм диференційованого вибору патогенетично обґрунтованого лікування пацієнтів.
Низка авторів говорить про важливу прогностичну роль рівня TNF-α в пацієнтів з діабетичною полінейропатією. Згідно з останніми дослідженнями, збільшення рівня TNF-α спостерігається й у пацієнтів з тяжким перебігом радикулопатій. Тому дослідження кореляцій стану пацієнта з TNF-α має наукове і велике практичне значення щодо корекції тактики лікування.
Наявність астенії в пацієнтів з полінейропатіями і радикулопатіями є одним з факторів погіршення прогнозу захворювання і збільшення тривалості лікування. Тому врахування і корекція наявного астенічного синдрому може стати одним з ключових елементів лікування хронічних захворювань периферичної нервової системи, таких як полінейропатія та радикулопатія.
Мета дослідження: вивчення ефективності й безпеки застосування препарату Ланейра в пацієнтів з діабетичною полінейропатією.
Матеріали та методи
На базі МЦ «Інститут неврології і психології» з лютого по квітень 2023 р. було обстежено 41 пацієнта із цукровим діабетом 2-го типу, з них 22 (53,7 %) чоловіки і 19 (46,3 %) жінок. Середній вік пацієнтів був 54,5 ± 7,6 року. За допомогою критерію Шапіро — Уїлка і Q-Q графіка було визначено нормальний розподіл пацієнтів, тому для подальшого аналізу використовувалися параметричні методи статистичного аналізу. Основну групу становили 22 (53,7 %) пацієнти, які до стандартного лікування додатково приймали препарат Ланейра, а в контрольну групу ввійшли 19 (46,3 %) пацієнтів зі стандартним лікуванням.
На першому візиті, перед взяттям у дослідження, пацієнтів було ознайомлено з метою та умовами проведення роботи. Пацієнти підписали інформовану згоду щодо проведення діагностичних процедур. Методика проведення дослідження відповідала вимогам Гельсінської декларації прав людини 1975 року та її переглянутої версії 1983 року, Європейської конвенції про права людини та біомедицину, а також законодавству України. Критеріями включення в дослідження були вік 25–85 років, наявність нейропатії та згода пацієнта. Критеріями невключення в дослідження були гострі нейропатії та психічні хвороби в анамнезі. Після підписання інформованої згоди пацієнти були обстежені за допомогою шкал DN-4 для діагностики нейропатичного болю, шкали тяжкості втоми (Function Status Scale, FSS) і шкали якості життя (36-Item Short Form Survey, SF-36), а також пацієнтам проведено електронейроміографічне обстеження і забір крові для визначення рівня TNF-α. Після обстеження пацієнтам рандомно видавався препарат Ланейра для щоденного прийому протягом 12 тижнів.
Після завершення визначеного терміну пацієнти були запрошені на другий візит для повторного огляду: їх знову обстежували за допомогою шкал DN-4, FSS і SF-36, електронейроміографії та повторно брали матеріал для визначення рівня TNF-α.
У пацієнтів, які взяли участь у дослідженні, було застосовано антропометричні, лабораторні й інструментальні методи обстеження. Антропометричні методи включали оцінювання зросту і маси тіла й обчислення індексу маси тіла (ІМТ) згідно з формулою:
IMТ = m/h2 (кг/м2),
де m — маса тіла (кг), h — висота тіла (м).
Шкала DN-4 включала 10 питань, з яких 7 стосувалися суб’єктивних відчуттів, а 3 — огляду пацієнта. За кожне питання при відповіді «так» присвоювався 1 бал, а при відповіді «ні» — 0 балів. При наборі пацієнтом 4 і більше балів діагностувався нейропатичний біль. Шкала тяжкості втоми складалася з 9 рубрик, кожна з яких оцінювалася від 1 до 7 балів. Сума балів визначала рівень втоми пацієнта, де 0–36 балів — немає втоми, 37–44 бали — помірна втома, 45–63 бали — виражена втома. Шкала якості життя включала 11 рубрик. Підрахунок результатів проводився за допомогою онлайн-калькулятора, де у відсотках визначався кінцевий показник. Інтерпретація: 0–20 % — низька якість життя, 21–40 % — знижена якість життя, 41–60 % — середня якість життя, 61–80 % — поліпшена якість життя, 81–100 % — висока якість життя.
Усім пацієнтам взято кров на дослідження для визначення рівня TNF-α і глікозильованого гемоглобіну.
Дослідження нервової провідності здійснювалося за допомогою апарата «Нейро-МВП-Микро» («Нейрософт»), вимірювалися такі показники нервової провідності: рeroneal motor nerve conduction velocity (PMNCV), peroneal motor nerve action potential (PMNAP), sensory nerve action potential (SNAP), sensory nerve conduction velocity (SNCV).
Аналіз та обробка отриманих даних проводилися за допомогою комп’ютерної програми Jamovi Version 2.3.26.0 для IOS. Номінальні показники незалежних вибірок порівнювали між групами пацієнтів за допомогою критерію χ2. Для відносних і порядкових ознак для незалежних вибірок спочатку визначали відповідність нормальності розподілу і застосовували критерій Стьюдента в модифікації Уелча у разі відповідності або критерій Манна — Уїтні в разі відхилення розподілу ознаки від нормального. При порівнянні парних вибірок порядкових і відносних ознак у разі нормального розподілу використовувався парний критерій Стьюдента або критерій Вілкоксона при відхиленні розподілу ознаки від нормального. Для вивчення кореляційного зв’язку використовувався критерій Пірсона.
Результати
На початку дослідження середній показник за шкалою DN-4 в основній групі становив 5,95 ± 1,68 бала, а в контрольній — 5,53 ± 1,93 бала. Через 12 тижнів лікування в основній групі спостерігалося більш виражене зниження показника DN-4, ніж у контрольній, він становив 3,86 ± 1,46 бала і 4,32 ± 1,60 бала відповідно зі статистично значимим результатом (W = 861; p < 0,00001) (рис. 1).
За шкалою тяжкості втоми на початку дослідження середній показник в основній групі становив 46,3 ± 14,8 бала, а в контрольній — 47,2 ± 10,2 бала. На контрольному огляді через 12 тижнів відзначалася тенденція до поліпшення в обох групах з більшим зниженням рівня втоми в основній групі — 33,6 ± 11,3 бала і 39,8 ± 8,62 бала (t = 12,3; p < 0,00001) (рис. 2).
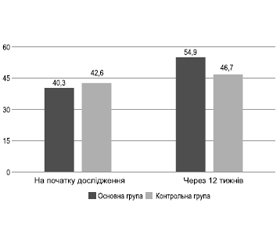
За шкалою якості життя SF-36 на початку дослідження рівень в основній групі становив 40,3 ± 19,7, а в контрольній — 42,6 ± 17,8 бала. Відповідно дані показники через 12 тижнів лікування збільшилися до 54,9 ± 16,5 і 46,7 ± 15,8 бала (t = –6,6; p < 0,00001), тобто в основній групі показник був кращим порівняно з контрольною зі статистично значимим результатом (рис. 3).
Рівень TNF-α в основній і контрольній групах на початку дослідження становив відповідно 8,40 ± ± 2,08 і 8,29 ± 3,36, а в кінці дослідження спостерігалося статистично значиме зменшення рівня даного медіатора в обох групах — 6,58 ± 1,58 і 6,96 ± 1,42 з більшим зниженням в основній групі (W = 685; р = 0,001) (рис. 4).
Порівнюючи групи між собою за показниками нервової провідності на початку і в кінці дослідження, не встановили статистично значимого результату щодо зміни провідності по нервових волокнах ні в основній, ні в контрольній групі (p > 0,05) (табл. 2).
При вивченні кореляційного зв’язку між фактором некрозу пухлини альфа та показниками шкал DN-4, FSS, SF-36 встановлено прямий напрямок кореляції із середньою силою зв’язку щодо вираженості нейропатичного болю (DN-4: r = 0,45; р = 0,003) і тяжкості втоми (FSS: r = 0,31; р < 0,05), а також обернену кореляцію із середньою силою зв’язку за рівнем якості життя (SF-36: r = –0,5, р = 0,0009) (рис. 5, табл. 3).
Висновки
1. Встановлено прямий кореляційний зв’язок між рівнем TNF-α і вираженістю нейропатії і рівнем втоми.
2. Виявлено обернений кореляційний зв’язок між рівнем TNF-α і показником якості життя.
3. TNF-α може використовуватися як маркер вираженості нейропатії.
4. В основній групі пацієнтів, які приймали препарат Ланейра, вираженість нейропатичного синдрому вдалося знизити на 35,12 % за 12 тижнів лікування, а в пацієнтів контрольної групи цей показник становив 21,88 %. Результат зниження нейропатичного синдрому за шкалою DN-4 в основній групі пацієнтів, які прий-мали препарат Ланейра, був на 60 % кращим за показник пацієнтів контрольної групи.
5. В основній групі пацієнтів, які приймали препарат Ланейра, було більш виражене зменшення рівня втоми — на 27,4 % за 12 тижнів лікування, а в другій групі пацієнтів цей показник становив усього 15,6 %. Результат зниження рівня втоми в основній групі пацієнтів, які приймали препарат Ланейра, був на 75,6 % кращим за показник пацієнтів контрольної групи.
6. В основній групі пацієнтів, які приймали препарат Ланейра, було більш виражене збільшення показника якості життя за SF-36 — на 36,3 % за 12 тижнів лікування, а в пацієнтів контрольної групи цей показник становив лише 9,6 %. Результат поліпшення якості життя в основній групі пацієнтів, які приймали препарат Ланейра, був у чотири рази кращим за показник пацієнтів контрольної групи.
7. В основній групі пацієнтів, які приймали препарат Ланейра, було більш виражене зменшення рівня TNF-α — на 21,6 % за 12 тижнів лікування, а в другій групі пацієнтів цей показник становив усього 16 %. Результат зниження рівня втоми в основній групі пацієнтів, які приймали препарат Ланейра, був на 35 % кращим за показник пацієнтів контрольної групи.
8. Препарат Ланейра доцільно використовувати як додаткову терапію при лікуванні діабетичної полінейропатії, тому що це забезпечило вірогідне поліпшення результатів при тестуванні нейропатичного болю, рівня втоми і рівня якості життя порівняно з контрольною групою.
9. Терапію препаратом Ланейра хворі переносили добре, жодних побічних ефектів не зареєстровано.
10. Дані нашого досвіду застосування препарату Ланейра дозволяють розглядати його як препарат вибору при лікуванні діабетичної полінейропатії через статистично значимий позитивний вплив на симптоматику захворювання.
Конфлікт інтересів. Не заявлений.
Отримано/Received 07.08.2023
Рецензовано/Revised 31.08.2023
Прийнято до друку/Accepted 02.09.2023
Список литературы
1. Global, regional, and national burden of diabetes from 1990 to 2021, with projections of prevalence to 2050: a systematic analysis for the Global Burden of Disease Study 2021. Lancet. 2023. Vol. 402. Is. 10397. P. 203-234. DOI: https://doi.org/10.1016/S0140-6736(23)01301-6.
2. Callaghan B.C., Little A.A., Feldman E.L., Hughes R.A. Enhanced glucose control for preventing and treating diabetic neuropathy. Cochrane Database Syst. Rev. 2012 Jun 13. 6(6). CD007543. doi: 10.1002/14651858.CD007543.pub2. PMID: 22696371; PMCID: PMC4048127.
3. Rahman M.H., Jha M. K., Suk K. Evolving insights into the pathophysiology of diabetic neuropathy: implications of malfunctioning glia and discovery of novel therapeutic targets. Current Pharmaceutical Design. 2016. Vol. 22. № 6. Р. 738-757.
4. Herder C., Lankisch M., Ziegler D. et al. Subclinical inflammation and diabetic polyneuropathy. Diabetes Care. 2009. 32(4). 680-682.
5. Mohja A. et al. Tumor necrosis factor-α is a novel biomarker for peripheral neuropathy in type II diabetes mellitus: a clinical and electrophysiological study. Egyptian Neurology and Rehabilitation. 2017. 44(2). 83-90.
6. Chanda D., Adhya S. Correlation of level of TNF-α with severity of Diabetic Polyneuropathy in Type-2 Diabetes Mellitus. Journal of Dental and Medical Sciences. 2016. 15(8). 13-15.
7. Ristikj-Stomnaroska D., Risteska-Nejashmikj V., Papazova M. Role of Inflammation in the Pathogenesis of Diabetic Peripheral Neuropathy. Open. Access. Maced. J. Med. Sci. 2019. 7(14). 2267-2270.
8. Purwata T.E. High TNF-alpha plasma levels and macrophages iNOS and TNF-alpha expression as risk factors for painful diabetic neuropathy. J. Pain. Res. 2011. 4. 169-75. doi: 10.2147/JPR.S21751. Epub 2011 Jun 29. PMID: 21811392; PMCID: PMC3141833.
9. Mu Z.P., Wang Y.G., Li C.Q., Lv W.S., Wang B., Jing Z.H. et al. Association Between Tumor Necrosis Factor-α and Diabetic Peripheral Neuropathy in Patients with Type 2 Diabetes: a Meta-Analysis. Mol. Neurobiol. 2017 Mar. 54(2). 983-996. doi: 10.1007/s12035-016-9702-z. Epub 2016 Jan 21. PMID: 26797519.
10. Shi X., Chen Y., Nadeem L., Xu G. Beneficial effect of TNF-α inhibition on diabetic peripheral neuropathy. J. Neuroinflammation. 2013 Jun 4. 10. 69. doi: 10.1186/1742-2094-10-69. PMID: 23735240; PMCID: PMC3679954.
11. Nádró B., Lőrincz H., Molnár Á., Szentpéteri A., Zöld E., Seres I. et al. Effects of alpha-lipoic acid treatment on serum progranulin levels and inflammatory markers in diabetic neuropathy. J. Int. Med. Res. 2021. 49(5). 3000605211012213. doi: 10.1177/03000605211012213. PMID: 34041950; PMCID: PMC8165837.
12. Сибіль М.Г. Клінічна біохімія. Львів, 2015.
13. Nghi Van Phung, Fei Rong, Wan Yue Xia, Yong Fan, Xian Yu Li, Shi An Wang, Fu Li Li. Nervonic acid and its sphingolipids: Biological functions and potential food applications. Crit. Rev. Food Sci. Nutr. 2023. 1-20. DOI: 10.1080/10408398.2023.2203753.
14. Song W. Cognitive improvement effect of nervonic acid and essential fatty acids on rats ingesting Acer truncatum Bunge seed oil revealed by lipidomics approach. Food Funct. 2022. 5. DOI: 10.1039/D1FO03671H.

/18.jpg)
/19.jpg)
/19_2.jpg)
/20.jpg)
/20_2.jpg)