Международный эндокринологический журнал Том 19, №6, 2023
Вернуться к номеру
Зміни кишкової мікробіоти у пацієнтів з метаболічно-асоційованим стеатозом печінки
Авторы: Комариця О.Й., Радченко О.М., Москва Х.А., Боровець М.О.
Львівський національний медичний університет імені Данила Галицького, м. Львів, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
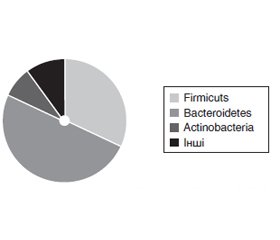
Актуальність. Сучасна наука розглядає зміни кишкової мікробіоти як патогенетичну ланку розвитку багатьох хвороб, зокрема метаболічно-асоційованої жирової хвороби печінки та стеатозу печінки (МАСП). Хоча дисбіоз є на кожній стадії розвитку жирової хвороби печінки, дотепер точно не встановлені типові ознаки окремо для МАСП, що зумовлює актуальність та доцільність нашого дослідження. Мета дослідження: охарактеризувати стан кишкової мікробіоти у пацієнтів з МАСП. Матеріали та методи. Обстежено 19 пацієнтів, з них 14 амбулаторних пацієнтів з метаболічним синдромом та МАСП і 5 пацієнтів без метаболічного синдрому з інтактною печінкою, які істотно відрізнялись лише за індексом маси тіла, з аналогічними гендерно-віковим розподілом, артеріальним тиском, параметрами ліпідного та вуглеводного метаболізму. Крім стандартних клініко-лабораторних обстежень, пацієнтам проведений метагеномний аналіз мікробіому кишечника методом полімеразно-ланцюгової реакції у сертифікований лабораторії. Пацієнти лікувались та обстежувались відповідно до нормативних документів та Гельсінської декларації прав людини. Цифрові результати опрацьовано статистично, рівень вірогідності р < 0,05. Результати. Зміни мікробіому кишечника у пацієнтів з жировою хворобою печінки починалися вже на стадії стеатозу та проявлялися збільшенням загальної бактеріальної маси на третину, нижчою кількістю облігатних штамів (Lactobacillus, Bifidobacterium, Bacteroides thetaiotaomicron, Akkemansia muciniphila) та збільшенням умісту умовно-патогенних штамів (Сlostridium perfringens, Klebsiella pneumonia, Klebsiella oxytoca, Escherichia coli enterоpathogenic, Shigella, Proteus, Salmonella) порівняно з пацієнтами з інтактною печінкою. Основну масу бактеріальних ДНК становили ДНК Bacteroidetes (50,66 %; порівняно з інтактною печінкою Δ = +8,29 %) та Firmicuts (31,97 ± 3,19 %; Δ = –10,87 %), тоді як 7,47 ± 2,69 % становили ДНК Actinobacteria (Δ = +40,41 %). Зміни метагеномного стану мікробіому кишечника пов’язані з масою тіла, системною гемоциркуляцією та ліпідним і вуглеводним метаболізмом. Висновки. За умов жирової хвороби печінки вже на стадії стеатозу спостерігався кишковий дисбіоз зі збільшенням загальної бактеріальної маси, нижчою кількістю облігатних та збільшенням умовно-патогенних штамів, що через метаболічні впливи може зумовлювати прогресування хвороби печінки.
Background. Modern science considers changes in the gut microbiota as a pathogenetic factor in the development of many diseases, including metabolic-associated fatty liver disease (MAFLD) and liver steatosis. Although dysbiosis is present at every stage of fatty liver disease, typical signs have not been identified separately for MAFLD that determines the relevance and expediency of our research. This investigation purposed to evaluate the state of the gut microbiota in patients with MAFLD. Materials and methods. In total, 19 patients were observed. Among them, 14 had metabolic syndrome and MAFLD and 5 were without metabolic syndrome with intact liver. These two groups differed significantly only in body mass index, had similar gender-age distribution, blood pressure, parameters of lipid and carbohydrate metabolism. Metagenomic analysis of the intestinal microbiome was performed by polymerase chain reaction in a certified laboratory in addition to standard clinical and laboratory examinations. Patients were treated and examined according to regulatory documents and the Declaration of Helsinki. Digital results were processed statistically, the level of significance was p < 0.05. Results. In patients with MAFLD, the changes in the gut microbiota began already at the stage of steatosis. They manifested by an increase in the total bacterial mass by a third, a lower number of obligate strains (Lactobacillus, Bifidobacterium, Bacteroides thetaiotaomicron, Akkermansia muciniphila) and an increased content of opportunistic pathogens (Сlostridium perfringens, Klebsiella pneumoniae, Klebsiella oxytoca, enterоpathogenic Escherichia coli, Shigella, Proteus, Salmonella) in contrast to patients with an intact liver. The bulk of bacterial DNA were DNA of Bacteroidetes (50.66 % compared to intact liver; Δ = +8.29 %) and Firmicutes (31.97 ± 3.19 %; Δ = –10.87 %) and Actinobacteria DNA (Δ = +40.41 %) made up 7.47 ± 2.69 %. Changes in the metagenomic status of the gut microbiota are associated with body weight, systemic blood circulation, lipid and carbohydrate metabolism. Conclusions. Alterations in the gut microbiota with an increase in total bacterial mass, a lower number of obligate and increased amount of opportunistic strains already at the stage of steatosis have been shown to correlate with the development and progression of fatty liver disease due to metabolic effects.
метаболічно-асоційований стеатоз печінки; дисбіоз; метагеномний стан мікробіому кишечника; облігатні штами; умовно-патогенні штами
metabolic-associated fatty liver disease; dysbiosis; metagenomic status of the intestinal microbiota; obligate strains; opportunistic strains
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Fadieienko H.D., Hridniev O.Ye., Kushnir I.E., Solomentseva T.A., Chernova V.M., Halchinska V. The role of intestinal microbiota, endotoxemia and systemic inflammation in the pathogenesis of nonalcoholic fatty liver disease. Lvivskyi klinichnyi visnyk. 2022. 3–4(3940). 8-13. (In Ukrainian).
- Safari Z., Gérard P. The links between the gut microbiome and non-alcoholic fatty liver disease (NAFLD). Cell Mol. Life Sci. 2019. 76(8). 1541-1558. DOI: 10.1007/s00018-019-03011-w.
- Panasevich M.R., Peppler W.T., Oerther D.B., Wright D.C., Rector R.S. Microbiome and NAFLD: potential influence of aerobic fitness and lifestyle modification. Physiol. Genomics. 2017. 49(8). 385-399. DOI: 10.1152/ physiolgenomics.00012.2017.
- Nistal E., Sáenz de Miera L.E., Ballesteros Pomar M., et al. An altered fecal microbiota profile in patients with non-alcoholic fatty liver disease (NAFLD) associated with obesity. Rev. Esp. Enferm. Dig. 2019. 111(4). 275-282. DOI: 10.17235/reed.2019.6068/2018.
- Plaza-Díaz J., Solís-Urra P., Rodríguez-Rodríguez F., et al. The Gut Barrier, Intestinal Microbiota, and Liver Disease: Molecular Mechanisms and Strategies to Manage. Int. J. Mol. Sci. 2020. 21(21). 8351. DOI: 10.3390/ijms21218351.
- Vallianou N., Christodoulatos G.S., Karampela I., et al. Understanding the Role of the Gut Microbiome and Microbial Metabolites in Non-Alcoholic Fatty Liver Disease: Current Evidence and Perspectives. Biomolecules. 2021. 31. 12(1). 56. DOI: 10.3390/biom12010056.
- Aragonès G., González-García S., Aguilar C., Richart C., Auguet T. Gut Microbiota-Derived Mediators as Potential Markers in Nonalcoholic Fatty Liver Disease. Biomed Res. Int. 2019(2). 1-10. DOI: 10.1155/2019/8507583.
- Cao Y., Yu M., Dong G., Chen B., Zhang B. Digital PCR as an Emerging Tool for Monitoring of Microbial Biodegradation. Molecules. 2020. 25(3). 706. DOI: 10.3390/molecules25030706.
- Magne F., Gotteland M., Gauthier L., et al. The Firmicutes/Bacteroidetes Ratio: A Relevant Marker of Gut Dysbiosis in Obese Patients? Nutrients. 2020. 12(5). 1474. DOI: 10.3390/nu12051474.
- Jandhyala S.M., Talukdar R., Subramanyam C., Vuyyuru H., Sasikala M., Reddy D.N. Role of the normal gut microbiota. World J. Gastroenterol. 2015. 21(29). 8787-8803. DOI: 10.3748/wjg.v21.i29.8787.
- Koliada A., Syzenko G., Moseiko V., et al. Association bet–ween body mass index and Firmicutes/Bacteroidetes ratio in an adult Ukrainian population. BMC Microbiol. 2017. 17(1). 120. DOI: 10.1186/s12866-017-1027-1.
- Binda C., Lopetuso L.R., Rizzatti G., Gibiino G., Cennamo V., Gasbarrini A. Actinobacteria: A relevant minority for the maintenance of gut homeostasis. Dig. Liver Dis. 2018. 50(5). 421-428. DOI: 10.1016/j.dld.2018.02.012.
- Yu Y., Lu J., Sun L., Lyu X., Chang X.Y., Mi X., et al. Akkermansia muciniphila: A potential novel mechanism of nuciferine to improve hyperlipidemia. Biomed Pharmacother. 2021. 133. 111014. DOI: 10.1016/j.biopha.2020.111014.