Международный неврологический журнал Том 19, №6, 2023
Вернуться к номеру
Поліморфізм генів АСЕ та AT2R1 у пацієнтів із хронічною судинною енцефалопатією: асоціація з нейровізуалізаційними змінами й когнітивним функціонуванням
Авторы: Дуве Х.В.
Тернопільський національний медичний університет імені І.Я. Горбачевського МОЗ України,
м. Тернопіль, Україна
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
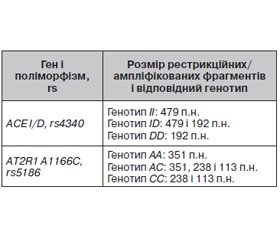
Актуальність. З огляду на синергічну дію генів ACE та АТ2R1 і їх вплив на підтримання гомеостатичних процесів метою нашої роботи було встановити асоціації досліджуваних поліморфних варіантів генів АСЕ та AT2R1 з нейровізуалізаційними змінами, даними ультразвукового дуплексного сканування судин і когнітивного функціонування в пацієнтів із хронічною судинною енцефалопатією (ХСЕ). Матеріали та методи. Обстежено 145 пацієнтів із ХСЕ, з них 18 пацієнтам було проведено молекулярно-генетичне дослідження. Контрольну групу становили 12 осіб, репрезентативних за віком і статтю. Нейровізуалізація проводилася за допомогою мультиспіральної комп’ютерної томографії або магнітно-резонансної томографії. Стан церебрального кровотоку вивчали за допомогою транскраніального дуплексного сканування інтракраніальних судин. Стан когнітивних функцій оцінювали за допомогою Монреальського когнітивного тесту. Результати. Аналізуючи асоціації поліморфних варіантів I/D гена АСЕ та A1166C гена AT2R1 з нейровізуалізаційними змінами й параметрами церебральної гемодинаміки у пацієнтів з ХСЕ, у носіїв алелей І і D гена АСЕ встановили вірогідний взаємозв’язок між їх частотним розподілом і наявністю/відсутністю явищ гліозу (у 62,69 % носіїв алелі D діагностовано явища гліозу, р < 0,05); вірогідну залежність між частотним розподілом генотипу D/D гена АСЕ та наявністю ангіоспазму (у 72,73 % осіб), недостатності кровотоку в каротидному басейні (у 72,73 % осіб) і вертебробазилярною недостатністю (у 36,36 % осіб). Оцінюючи залежність когнітивних функцій за результатами аналізу Монреальського когнітивного тесту в пацієнтів з ХСЕ від поліморфних варіантів I/D гена АСЕ та A1166C гена AT2R1, виявили вірогідні зміни щодо розподілу частот генотипів і алелей поліморфного варіанта I/D гена АСЕ (χ2 = 11,33; р = 0,023), при цьому всі носії генотипу D/D мають порушення когнітивного функціонування (36,36 % осіб — помірний когнітивний дефект і 63,64 % осіб — легкий когнітивний дефект), що відповідає також частоті розподілу алелі D у даної когорти пацієнтів (29,63 % осіб мають помірний когнітивний дефект і 70,37 % осіб — легкий когнітивний дефект, р = 0,013). Висновки. Результати дослідження свідчать про те, що ген АСЕ може брати участь у розвитку нейровізуалізаційних змін і когнітивних порушень при ХСЕ.
Background. Given the synergistic effect of the ACE and AT2R1 genes and their impact on the maintenance of homeostatic processes, the aim of our research was to identify the associations of the studied polymorphic variants of the ACE and AT2R1 genes with neuroimaging changes, data from arterial duplex ultrasound and cognitive functioning in patients with chronic vascular encephalopathy (CVE). Materials and methods. A retrospective analysis of 145 medical records of patients with CVE was conducted, of which 18 patients underwent a molecular genetic study. The control group consisted of 12 people representative in terms of age and gender. Neuroimaging was performed using multislice computed tomography or magnetic resonance imaging. The state of cerebral blood flow was studied using transcranial duplex ultrasound of intracranial and extracranial vessels. The cognitive functioning was tested using the Montreal Cognitive Assessment. Results. When analyzing the associations of polymorphic I/D variants of the ACE gene and A1166C of the AT2R1 gene with neuroimaging changes and parameters of cerebral hemodynamics in CVE among carriers of I and D alleles of the ACE gene, a probable relationship was found between their frequency distribution and the presence/absence of gliosis phenomena (62.69 % of D allele carriers were diagnosed with gliosis, p < 0.05); a probable relationship between the frequency distribution of the D/D genotype of the ACE gene and the presence of angiospasm (in 72.73 % of patients), insufficiency of blood flow in the carotid system (72.73 % of cases) and vertebrobasilar insufficiency (in 36.36 % of people). When evaluating the dependence of cognitive functions based on the Montreal Cognitive Assessment score in patients with CVE on the polymorphic I/D variants of the ACE gene and A1166C of the AT2R1 gene, probable changes were revealed in the frequency distribution of genotypes and alleles of the polymorphic I/D variant of the ACE gene (χ2 = 11.33; p = 0.023), while all carriers of the D/D genotype have impaired cognitive functioning (moderate in 36.36 % and mild in 63.64 % of cases), which also corresponds to the frequency of the D allele distribution in this cohort of patients (29.63 % of people have a moderate cognitive impairment and 70.37 % — a mild cognitive impairment, p = 0.013). Conclusions. The study results indicate that the ACE gene may be involved in the development of neuroimaging changes and cognitive decline in CVE.
хронічна судинна енцефалопатія; когнітивна функція; ген АСЕ; ген AT2R1
chronic vascular encephalopathy; cognitive function; ACE gene; AT2R1 gene