Інсульт продовжує залишатися однією з головних причин смерті й інвалідності в усьому світі: у 2019 році було зареєстровано 12,2 мільйона нових випадків (серед яких 62,4 % — ішемічний інсульт) і 6,55 мільйона смертей [1]. Прогнозується, що до 2040 року інсульт, який є основною проблемою системи охорони здоров’я, утримає свої позиції в списку причин втрачених років життя [2]. У питаннях невідкладної терапії інсульту останніми десятиліттями спостерігається значний прогрес, це привело до значного зниження рівня смертності [3], тоді як прогрес у нейрореабілітації привів до поліпшення результатів після інсульту [4]. Для полегшення глобального тягаря інсульту необхідне постійне розширення мереж медичної допомоги, поліпшення стандартів медичної допомоги й належне впровадження рекомендацій щодо первинної та вторинної профілактики [5, 6]. Зміна вікового розподілу населення і збільшення економічного тягаря інновацій у сфері технологій охорони здоров’я мають серйозні наслідки як для пропозиції, так і для попиту на медичні послуги [7, 8]. Пандемія COVID-19 спричинила значні порушення в цій і без того крихкій рівновазі, перенаправляючи ресурси і змінюючи пріоритети надання медичних послуг [9, 10], породжуючи багато непередбачених потреб у медичній допомозі як для інфекційних, так і для неінфекційних захворювань і провокуючи деякі невдачі щодо лікування інших захворювань [11]. Усе більше доказів вказує на те, що кількість госпіталізацій після інсульту значно зменшилася під час пандемії [12–15], а виміряний час надання допомоги при гострому стані («від дверей до нейровізуалізаційного обстеження», «від дверей до голки», «від дверей до встановлення катетера», «від дверей до реперфузії») зріс [16].
Здатність країн одночасно долати кризи й відповідати на довгострокові виклики значною мірою залежить від їх соціально-економічного стану [17], оскільки збіднілі системи охорони здоров’я менш спроможні зосередитися на мінливих потребах населення в охороні здоров’я [18]. У контексті низьких витрат на охорону здоров’я факторами, що часто значною мірою перешкоджають поліпшенню здоров’я населення, є нестабільний розподіл ресурсів і погані механізми оцінки технологій охорони здоров’я. У результаті цієї сукупності детермінант системи охорони здоров’я перебувають у безпрецедентному становищі, змушені функціонувати в умовах бюджетних обмежень, подібних до періоду до пандемії. Розробка і включення доказів економічної ефективності при прийнятті рішень у сфері охорони здоров’я і розподілі ресурсів стають надзвичайно важливими, навіть коли світ готується повернутися до «нормального життя», коли COVID-19 досягне ендемічної фази [17].
Можливості лікування інсульту швидко розвиваються, і впровадження нових терапевтичних підходів і технологій має велике значення для поліпшення результатів лікування пацієнтів і зменшення навантаження на системи охорони здоров’я. З постарінням населення і ростом поширеності факторів ризику, таких як артеріальна гіпертензія, ожиріння і цукровий діабет, попит на ефективне, у тому числі з економічної точки зору, лікування інсульту продовжуватиме зростати [1]. Крім того, складність і взаємопов’язаний характер патофізіології та лікування інсульту вимагають мультидисциплінарного підходу, який може виявитися складним у контексті обмежених ресурсів і конкуруючих пріоритетів охорони здоров’я [19].
Оскільки системи охорони здоров’я в усьому світі прагнуть оптимізувати розподіл ресурсів і поліпшити результати лікування пацієнтів, аналіз економічної ефективності відіграє вирішальну роль у формуванні політичних рішень і рекомендацій щодо клінічної практики [20]. Інтеграція економічних оцінок у процес прийняття рішень може допомогти визначити найбільш ефективне використання обмежених ресурсів охорони здоров’я і сприяти появі нових оптимальних методів лікування [21]. З огляду на значний вплив інсульту на людину й економіку оцінка економічної ефективності нових методів лікування має особливе значення для забезпечення того, щоб системи охорони здоров’я могли надавати адекватну допомогу при збереженні фінансової стабільності [22].
Церебролізин є перспективним біологічним агентом, який імітує біологічну дію нейротрофічних факторів, сприяючи як нейропротекції, так і нейровідновленню після ішемічного інсульту. Нещодавно його було включено до декількох клінічних настанов [23–25] і особливо рекомендовано як додаткове лікування в помірно тяжких випадках інсульту. Церебролізин — препарат на основі пептидів, отриманий із тканини головного мозку свиней, який містить суміш нейротрофічних факторів і активних пептидів, що демонструють нейропротекторні та нейровідновлювальні властивості. Механізм дії Церебролізину багатогранний, включає зменшення запалення, зниження апоптозу, посилення нейрогенезу і підвищення синаптичної пластичності [26]. Ці комбіновані ефекти сприяють поліпшенню неврологічних результатів і функціональному відновленню пацієнтів з ішемічним інсультом. Кілька клінічних досліджень продемонстрували ефективність і безпеку Церебролізину як допоміжної терапії до стандартної терапії інсульту з кращими функціональними результатами і меншою частотою побічних ефектів порівняно з плацебо [27, 28]. Церебролізин продемонстрував потенційну користь при інших неврологічних розладах, таких як хвороба Альцгеймера і черепно-мозкові травми [29–31]. Існує мало доказів щодо профілю економічної ефективності Церебролізину, незважаючи на те, що цей аспект є частиною стандартів медичної допомоги [32, 33].
Наше дослідження має на меті розширити поточні знання з цієї теми, забезпечивши нову оцінку вартості й корисності Церебролізину як додаткового лікування помірного і тяжкого ішемічного інсульту. Розуміння профілю економічної ефективності препарату має вирішальне значення для інформування осіб, які прий-мають рішення, і клініцистів про потенційну цінність препарату в лікуванні ішемічного інсульту. Оскільки системи охорони здоров’я стикаються з проблемами надання високоякісної медичної допомоги в умовах бюджетних обмежень, створення надійних доказів економічної ефективності Церебролізину може допомогти підтримати його інтеграцію в клінічну практику й оптимізувати використання обмежених ресурсів.
Крім того, дослідження економічної ефективності в контексті румунської системи охорони здоров’я є особливо актуальним з огляду на її унікальні виклики і необхідність прийняття рішень на основі доказів. Румунія стикається зі значними розбіжностями в доступі до медичних послуг, особливо в сільській місцевості, і характеризується високим ступенем фрагментації надання послуг [34]. Крім того, витрати на охорону здоров’я в країні є одними з найнижчих у Європейському Союзі, що призводить до того, що потреба в якісній медичній допомозі значною мірою не задовольняється [35]. Проводячи аналіз вартості й ефективності Церебролізину в умовах стаціонарного лікування в Румунії, це дослідження має на меті надати цінну інформацію для політиків і постачальників медичних послуг щодо задоволення конкретних потреб і вирішення проблеми обмежень. Крім того, вторинний аналіз дослідження CARS дає унікальну можливість оцінити економічну ефективність Церебролізину, використовуючи реальні дані добре спланованого клінічного дослідження. Результати цього дослідження, у якому використані індивідуальні дані пацієнтів і фактичні витрати на невідкладну допомогу, про які звітують румунські державні лікарні, можуть допомогти подолати розрив між клінічною ефективністю й економічними наслідками використання Церебролізину як додаткової терапії гострого ішемічного інсульту середньої тяжкості.
Це дослідження має на меті забезпечити комплексну оцінку економічної ефективності Церебролізину в контексті румунської системи охорони здоров’я, сприяючи розвитку доказової бази його потенційної цінності для поліпшення результатів інсульту й інформування для прийняття рішень у сфері охорони здоров’я. Поєднуючи клінічні, економічні й політичні перспективи, наше дослідження має на меті пролити світло на складну взаємодію між лікуванням інсульту, розподілом ресурсів і наслідками для здоров’я, зрештою, надаючи цінну інформацію для постійного розвитку і вдосконалення стратегій лікування інсульту.
Матеріали та методи
Використовуючи детерміністичний та імовірнісний підходи, ми провели оцінку вартості й корисності для обчислення додаткового коефіцієнта ефективності (ICER) Церебролізину, спираючись на інформацію, зібрану з багатьох джерел. Детерміновані методи (з використанням фіксованих вхідних значень) в економічних оцінках включають обчислення рентабельності за допомогою одноточкових оцінок для всіх вхідних параметрів, таких як витрати, ефективність і корисність. Цей підхід не враховує невизначеність або мінливість у вхідних параметрах, і, отже, результати можуть не відображати повний діапазон можливих результатів. Імовірнісні методи (що включають невизначеність) в економічних оцінках, з іншого боку, використовують розподіли ймовірностей для вхідних параметрів для врахування невизначеності й мінливості. Виконуючи багаторазове моделювання, ці методи генерують низку можливих результатів, забезпечуючи більш повне розуміння економічної ефективності й імовірності виникнення різних сценаріїв. Через характер збору даних (вторинний аналіз даних клінічних випробувань; витяг знеособлених і агрегованих значень витрат для різних сценаріїв лікування) для цього дослідження не було потрібно схвалення Інституційної ревізійної ради. Щоб сформувати моделі лікування пацієнта і витрати, ми вибрали основну установу надання медичної допомоги з єдиного доступного клінічного дослідження, яке можна використовувати для визначення корисності стаціонарного лікування гострого ішемічного інсульту на базі домінуючої країни-учасниці (Румунія). Цей аналіз проводився з точки зору платника на основі попередньо визначеної послідовності (рис. 1).
/21.jpg)
Корисні опції для втручання і стандартів догляду
Ми отримали індивідуальні дані пацієнтів з дослідження «Церебролізин і відновлення після інсульту» (CARS) 2016 року від головних дослідників [36]. Демографічні дані пацієнтів, дані історій хвороби, інформація про фактори ризику й результати 36-Item-Short-Form-Survey (SF-36) (n = 208) були перенесені в Microsoft Excel і додатково оброблені й проаналізовані для оцінки базової порівнянності й отримання даних про кожного пацієнта щодо Церебролізину в паралельній квазіекспериментальній парадигмі. Дані SF-36 були наведені у вигляді балів на 2-й і 90-й день після початку інсульту (візит 2 і візит 7 відповідно). Отримана база даних включала 198 пацієнтів. Значення SF-36 були перетворені в показники корисності для здоров’я за допомогою конвертерів [37], розроблених Школою охорони здоров’я і споріднених досліджень (ScHARR) в Університеті Шеффілда. Якщо дані SF-36 були відсутні в більше ніж 3 підшкалах SF-36 під час будь-якого візиту, ці випадки було виключено (n = 10) або перекодовано (n = 13) згідно з інструкціями SF-36 в SF-6D щодо конвертера балів. Інструмент генерував три різні типи показників корисності за допомогою стандартних моделей оцінки стану здоров’я, порядкових і баєсівських середніх значень, отриманих апостеріорі. Через відсутність значень конвертер виключив додаткові 5 випадків, у результаті чого до остаточного аналізу було включено 193 пацієнти (100 — група Церебролізину; 93 — група плацебо).
Отримані показники корисності були використані для розрахунку кількості років життя з поправкою на якість (QALY) протягом першого року після інсульту. Для кожного пацієнта було отримано три значення на основі моделей оцінки стану здоров’я, які використовуються в інструменті конвертації. Формула, використана для розрахунку QALY для кожного окремого пацієнта, була такою:
((2 × D2 + 88 × Середній вік (D2, D90))/90) × 0,25,
де D2 — це оцінка корисності за день 2; D90 — оцінка корисності за 90-й день.
Припущення в цьому розрахунку QALY відповідають визначенням і графіку відновлення після інсульту, встановленому Bernhardt et al. (2017), де реєструється поліпшення в гострій і ранній підгострій стадіях (до 90-го дня), після чого настає плато нейровідновлення [38].
Отримання інформації щодо витрат при гострому ішемічному інсульті
Дані про витрати на стаціонарне стандартне лікування інсульту було визначено шляхом аналізу фактичних витрат на госпіталізацію в невідкладній стадії дослідження CARS. Повідомлені суми включають прямі (заробітна плата персоналу, ліки, витратні матеріали, діагностичні послуги) і непрямі (адміністративні й накладні витрати) лікарняні витрати, пов’язані зі стаціонарним лікуванням. Витрати були конвертовані з RON у євро на основі середнього курсу конвертації за період з 15 листопада по 15 грудня 2021 року (1 євро = 4,95 RON) та округлені до найближчого цілого значення. Вартість однієї терапевтичної одиниці (10 мл) Церебролізину була отримана на веб-сторінці Румунського національного медичного страхування (5,5 євро за флакон 10 мл). Ця вартість являє собою максимальну ціну, встановлену національним законодавством, і охоплює найдорожчий сценарій. Враховуючи, що курс лікування, який використовувався в дослідженні CARS, полягав у призначенні 30 мл Церебролізину на добу, розведеного фізіологічним розчином до загального об’єму 100 мл, ми додали вартість флакона 100 мл фізіологічного розчину (0,6 євро), вартість трьох флаконів Церебролізину по 10 мл. Ціна на флакон із фізіологічним розчином об’ємом 100 мл була розрахована шляхом збору цін на 20 коробок з флаконами з 3 незалежних джерел (веб-сайти основних дистриб’юторів фармацевтичних продуктів у Румунії) та усереднення ціни за флакон. Отримана ціна описує теоретичну добову вартість додаткової терапії Церебролізином у дослідженні CARS щодо стандартного лікування ішемічного інсульту. Потім розмір витрат був конвертований на основі базового курсу конвертації валют і округлений до найближчого десяткового значення. Витрати на інфузію в разі гострих випадків (менше за 21 день) були оцінені в 150 RON (30 євро) на день. Щодо витрат на невідкладну допомогу була застосована річна ставка дисконту 3 %.
Розрахунок додаткового співвідношення витрат і ефективності додаткової терапії Церебролізином при ішемічному інсульті за допомогою детерміністичного підходу
Підрахувавши описані вище витрати, ми розрахували додаткові коефіцієнти ефективності (ICER) для додаткової терапії Церебролізином порівняно зі стандартним лікуванням ішемічного інсульту в дослідженні CARS: 30 мл на день, розведених у фізіологічному розчині до загального об’єму 100 мл, тривалість лікування — 21 день. Формула, використана для розрахунку додаткових коефіцієнтів ефективності витрат у всіх сценаріях, така:
[Вартість Церебролізину (A) – вартість стандартного лікування (B)]/[QALYs Церебролізин (C) – QALYs плацебо (D)].
Ми розрахували три значення ICER, по одному для кожної з трьох різних моделей оцінки стану здоров’я, які використовувалися для генерації показників користі для здоров’я, на основі яких були розраховані QALY.
Імовірнісний аналіз чутливості
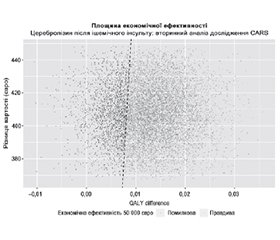
Імовірнісний аналіз чутливості (PSA) був проведений для вирішення проблеми невизначеності параметрів і гіпотетично можливих сценаріїв та вхідних даних, що використовуються для детермінованих розрахунків ICER. Ми використовували спеціальну електронну таблицю MS Excel для виконання 10 000 симуляцій ICER для кожного пацієнта і подали їх на рівнях економічної ефективності. Криві прийнятності економічної ефективності (CEAC) були створені шляхом розрахунку ймовірностей економічної ефективності втручання проти порогових приростів до 50 000 євро.
Випадкову вибірку PSA проводили на основі логарифмічного нормального (QALY) або рівномірного (вартість) розподілу. Найвищі й найнижчі сукупні значення за моделлю оцінки стану здоров’я використовувалися як верхня і нижня межі розподілу QALY для груп пацієнтів.
Результати
Ми порівняли базові характеристики (демографічні дані, тяжкість інсульту, сімейний і медичний анамнез) 193 пацієнтів, для яких ми розрахували показник QALY. Вірогідних відмінностей виявлено не було, що дозволило провести релевантне порівняння показників здоров’я між групами Церебролізину і плацебо.
Показники QALY, розраховані з використанням показників користі, отриманих у результаті перетворення SF-36 у SF-6D, були створені за моделлю оцінки стану здоров’я: стандартний показник (0,698 Церебролізину проти 0,643 плацебо), порядковий показник (0,704 Церебролізину проти 0,647 плацебо) і баєсівські середні значення (0,653 Церебролізину проти 0,613 плацебо). Середні загальні витрати на одного пацієнта становили 7214 RON (1458 євро) для Церебролізину і 5197 RON (1050 євро) для плацебо. Це дорівнює середньому приросту різниці у вартості лікування у 2017 RON (408 євро) між пацієнтами, які отримували Церебролізин і стандартне лікування, як зазначено в табл. 1, і середньому приросту QALY між 0,01–0,015, залежно від методики оцінки (табл. 2).
Три різні значення ICER, що відповідають використаним моделям оцінки стану здоров’я, подані в табл. 2. Найнижчі значення ICER були визначені на основі порядкової оцінки (18 788 євро/QALY), а найвищі — у разі використання методу баєсівської оцінки апостеріорі (26 981 євро/QALY).
Імовірнісний аналіз чутливості
На основі даних з дослідження CARS лікування Церебролізином було економічно ефективним приблизно у 80 % випадків для порогового значення ICER, встановленого на рівні 50 000 євро (рис. 2, 3), враховуючи лише 90-денний період дослідження CARS.
Обговорення
Метою даного дослідження було оцінити економічну ефективність додаткової терапії Церебролізином порівняно зі стандартною терапією при гострому ішемічному інсульті шляхом розрахунку значень ICER для різних сценаріїв витрат з використанням детерміністичних та імовірнісних методів. Припускаючи, що терапія Церебролізином не створює додаткових витрат, пов’язаних з додатковою госпіталізацією, ми дійшли висновку, що препарат є економічно ефективним у 80 % випадків з урахуванням високого порогу готовності платити. Наші висновки узгоджуються з такими в наявній літературі на цю тему, кількість якої є обмеженою [32, 33], надаючи вкрай необхідні додаткові докази економічної ефективності цієї терапії. Наступним кроком мав би бути аналіз впливу на бюджет, який супроводжував би результати нашого дослідження [39].
Kulikov і Abdrashitova провели аналіз ефективності використання Церебролізину у хворих на інсульт середнього й тяжкого ступеня, у якому як критерій ефективності виділили кількість років життя (LYG). Їх дослідження показало, що Церебролізин (порівняно зі стандартною терапією інсульту) є домінуючим способом втручання. CER (коефіцієнт ефективності) для Церебролізину був на 2367 євро меншим порівняно зі стандартною терапією інсульту [32]. Walter et al. [33] застосували модель Маркова з урахуванням 10-річного терміну з точки зору платника, використали дані mRS, отримані (з багатьох джерел) на 90-й день після інсульту, і повідомили про користь застосування Церебролізину з точки зору QALY і років життя (LY). Це дослідження продемонструвало, що Церебролізин є економічно ефективним, оскільки він зменшує витрати на пацієнтів з інсультом у відділеннях невідкладної допомоги й у будинках людей похилого віку. Однак різниця між Церебролізином і rt-PA дещо вища порівняно з rt-PA для першого сценарію (3,77 проти 3,75 QALY).
Крім того, наше дослідження включає методологію лікування, подану в CARS, яка передбачає подовжену тривалість госпіталізації для завершення 21-денного періоду лікування Церебролізином. Ці обставини стосуються медичних закладів, у яких дотримуються вказівок експертних організацій щодо впровадження комплексних ініціатив з фізичної реабілітації після ішемічного інсульту [40, 41]. У цьому контексті ми встановили, що Церебролізин є економічно ефективним у 80 % випадків, якщо розглянути більш високу межу готовності платити. Навпаки, нижчий поріг робить втручання менш фінансово життєздатним, вказуючи на те, що застосування Церебролізину в амбулаторних умовах після швидкої виписки зі стаціонару буде відповідною альтернативою подовженню перебування в лікарні виключно для призначення Церебролізину, що створить невиправданий фіскальний тягар для бюджетів охорони здоров’я.
Наскільки нам відомо, це дослідження дає першу справжню оцінку зміни значень QALY між стандартною терапією та застосуванням Церебролізину для лікування ішемічного інсульту протягом першого року після розвитку інсульту. QALY в групі Церебролізину були вищими, ніж у групі плацебо (0,051 — середня різниця між трьома моделями оцінки стану здоров’я), що вказує на те, що призначення Церебролізину має сприятливий вплив на якість життя пацієнтів з ішемічним інсультом. Конвертер SF-36 у показники корисності для здоров’я від Університету Шеффілда надає три варіанти показників: стандартний показник, порядковий показник і баєсівські середні значення. Кожен з них використовує різні моделі оцінки стану здоров’я. Стандартна модель базується на концепції переваги ризику, згідно з якою індивідуумам пропонується вибрати між певним результатом для здоров’я і ймовірністю ідеального здоров’я або менш бажаного результату. У такому випадку враховуються індивідуальні переваги і толерантність до ризику щодо різних станів здоров’я. Модель порядкового підходу, з іншого боку, ранжирує стани здоров’я відповідно до їх бажаності, не враховуючи величину переваги між ними. Цей підхід є простішим у застосуванні, але він може не охопити повний спектр відмінностей переваг між станами здоров’я. Нарешті, модель баєсівських середніх значень, розрахованих апостеріорі, об’єднує попередні дані й спостережні дані для отримання балів корисності для здоров’я. Цей метод враховує невизначеність і дає можливість оновлювати показники корисності, коли з’являються нові дані. Використання всіх трьох моделей оцінки і порівняння їх результатів дає розуміння надійності й чутливості отриманих показників корисності. На основі цього можна стверджувати, що немає потенційних змін у перевагах і ставленні до ризику, які можуть вплинути на загальний аналіз ефективності витрат.
Наші висновки слід інтерпретувати в поєднанні з вибраним середовищем дослідження. Система охорони здоров’я Румунії, заснована на соціальному медичному страхуванні, спирається на значну участь уряду, при цьому Міністерство охорони здоров’я (МОЗ) відіграє центральну роль у регулюванні, контролі й координації. Управління громадського здоров’я на рівні округів виконує директиви МОЗ і контролює місцеві завдання охорони здоров’я. МОЗ також координує діяльність інших державних установ охорони здоров’я, таких як Національний дім медичного страхування, Національне агентство з лікарських засобів і медичних виробів і Національний орган з управління якістю в охороні здоров’я. Місцева влада і парламент Румунії також впливають на систему охорони здоров’я. У Румунії система охорони здоров’я приділяє значну увагу стаціонарній медичній допомозі, а первинній, амбулаторній і профілактичній допомозі приділяється недостатньо уваги. Доступ до медичної допомоги залишається проблемою, особливо в сільській місцевості, що призводить до високого рівня незадоволених медичних потреб. Лікування інсульту в Румунії включає багато зацікавлених сторін, включно з невідкладною медициною, інтенсивною терапією, неврологією, нейрохірургією, радіологією та реабілітацією. На догоспітальному етапі керують служба швидкої медичної допомоги і мобільна служба екстреної реанімації. Пацієнти транспортуються до лікарень, де є спеціалізовані відділення невідкладної допомоги. Процес реабілітації починається в неврологічному відділенні або спеціальному реабілітаційному відділенні [42].
У 2015 році МОЗ запровадило програму «Пріоритетна дія — інсульт» (PAS) для фінансування реперфузійного лікування гострого ішемічного інсульту й ендоваскулярного лікування субарахноїдальних крововиливів. Спочатку програма охоплювала 10 лікарень, а до 2021 року розширилася до 44 лікарень, де проводять внутрішньовенний тромболізис (ВВТ). Однак лише кілька лікарень можуть виконувати ендоваскулярну тромбектомію (ЕВT) у пацієнтів з інсультом, тоді як решта можуть проводити лише внутрішньовенний тромболізис. Слід зазначити, що більшість лікарень не відповідають комплексним стандартам інсультних відділень, визначеним Європейською організацією з лікування інсульту (ESO) [43]. За даними Міністерства охорони здоров’я Румунії, з 2015 по 2018 рік близько 1800 пацієнтів отримали реперфузійне лікування за програмою PAS. Частка пацієнтів, які отримували лікування ВВТ, у 2017 році становила 0,8 %. До 2022 року реперфузійне лікування отримали 3242 пацієнти, що становить 7,8 % усіх пацієнтів з ішемічним інсультом. Це знаменує значне поліпшення, але не відповідає оцінці пацієнтів, які підходять для фармакологічної реперфузії, і рекомендованому ESO мінімальному показнику 15 % для ВВT. У 2021 році лише 0,9 % пацієнтів пройшли EВT, що значно нижче від оцінених 10 % відповідних пацієнтів і 5 % мети ESO на 2030 рік [44].
Вартість лікування Церебролізином відшкодовується в Румунії у разі гострого стану й у відкритому фармацевтичному контурі за списком B (50 % відшкодування). Це означає, що на сьогодні існує комбінація способів використання і протоколів з огляду на відшкодування 10–50 мл щоденної дози для лікування ішемічного інсульту. Отже, неможливо виміряти вплив на бюджет використання рекомендованої протоколом CARS дози лікування без високоякісного обсерваційного дослідження, щоб оцінити, як і скільки Церебролізину зараз використовується. Можливість вивчити цю тему з’явиться після завершення дослідження реєстру C-REGS 2 [45]. Однак на основі даних про кількість інсультів, повідомлених Румунським товариством неврології в 2022 році (n = 37,225), є грубе припущення, що приблизно 80 % випадків є ішемічними [46], і з них дві третини випадків — помірно тяжкого ступеня і, отже, є показаннями для лікування Церебролізином. Додаткова різниця у вартості порівняно з нашим дослідженням (408 євро) та оцінений вплив на бюджет лікування пацієнтів з гострим інсультом протягом 21 дня Церебролізином відповідно до протоколу CARS становитиме приблизно 8,5 мільйона євро на рік, що становить приблизно 5 % економічного тягаря охорони здоров’я від інсульту в країні [43, 47]. На додаток до цього пропорційно невеликого розрахункового впливу на бюджет (який, ми наголошуємо, імовірно, переоцінений у таких валових розрахунках), враховуючи, що загальні витрати на інсульт у Румунії в десять разів менші, ніж в інших країнах Європи, і поточну тенденцію до збільшення витрат на національному рівні [46, 48], ми стверджуємо, що нормалізація лікування Церебролізином відповідно до протоколу CARS приведе до керованого бюджетного впливу на румунську систему охорони здоров’я.
Обмеження нашого дослідження здебільшого пов’язані з умовами лікування, у яких визначали результати лікування Церебролізином і на яких ґрунтувалася калькуляція. У той час як 21-денний курс лікування є більш ніж оптимальним, рекомендація керівництва щодо застосування Церебролізину протягом мінімум 10 днів [23] дозволяє оцінити економічну ефективність цього препарату для більш коротких курсів лікування. Такі аналізи ще більше підтвердять нашу точку зору щодо економічної життєздатності Церебролізину і можуть стати переконливими доказами для його широкого впровадження навіть у системах охорони здоров’я з меншими ресурсами. Інформація, отримана в результаті нашого дослідження, хоч і формує сприятливий профіль економічної ефективності Церебролізину, вимагає подальшої економічної оцінки цього лікування в різних закладах охорони здоров’я, а також різних шляхів лікування пацієнтів і вивчення таких питань, як вплив призначення Церебролізину на прямі медичні витрати, рецидиви і наслідки після 90-денного періоду дослідження CARS.
Ці обмеження врівноважені широтою нашого методологічного підходу і набором інструментів, що використовуються. По-перше, дані про медичну користь Церебролізину і стандартної медичної допомоги були отримані з використанням трьох різних моделей оцінки стану здоров’я, що призвело до трьох типів значень ICER. Крім того, наш аналіз чутливості ймовірності враховує кілька профілів пацієнтів і шляхів у конкретному медичному закладі. Дані іншого дослідження, що оцінювало вартість стаціонарного лікування інсульту в тих самих умовах [47], показали подібні значення для госпіталізації, як і наші розрахунки витрат. Теоретична вартість курсу лікування Церебролізином розрахована з урахуванням його максимально можливої вартості. Найсильніша перевага нашого підходу, однак, полягає в одночасному використанні детермінованих і ймовірнісних методів. Детермінований метод створює конкретні значення, які можна порівняти з конкретними пороговими значеннями ICER, навіть незважаючи на те, що існує багато дискусій навколо способу встановлення і використання порогових значень готовності платити [49]. Імовірнісний метод охоплює різноманітні сценарії витрат і результатів, дійсні в системах охорони здоров’я як з багатими, так і з обмеженими ресурсами, і надає широку перспективу щодо економічних наслідків, які визначаються використанням Церебролізину.
Вихід систем охорони здоров’я з парадигми пандемії стає обов’язковим для більш послідовного використання економічних даних у прийнятті рішень у сфері охорони здоров’я і розподілі ресурсів. Оскільки тягар інсульту, за оцінками, в наступні десятиліття зросте [50], стратегії лікування інсульту необхідно ретельно розробляти й регулярно переглядати, щоб досягти балансу між поліпшенням здоров’я і збереженням його рівня. Такий підхід вимагає постійної оцінки економічної ефективності як існуючих, так і нових методів лікування інсульту на основі нових даних щодо витрат і результатів.
Наші результати вказують на сприятливий профіль економічної ефективності лікування Церебролізином при гострому ішемічному інсульті середнього і тяжкого ступеня на основі парадигми лікування CARS за умов порога економічної ефективності 50 000 євро. Пороги економічної ефективності використовуються для визначення того, чи вважається втручання економічно ефективним порівняно з відповідною альтернативою, такою як стандартна медична допомога. Ці порогові значення зазвичай становлять максимальну суму, яку особа, яка приймає рішення, наприклад платник медичних послуг, готова заплатити за додаткову одиницю показника здоров’я, наприклад рік життя, з поправкою на якість (QALY). Важливо зазначити, що не існує універсально узгодженого порогу, оскільки відповідне значення залежить від конкретного контексту, включно із системою охорони здоров’я, готовністю країни платити й досліджуваною галуззю захворювання.
У нашому аналізі чутливості ми вибрали порогове значення в 50 000 євро як максимальний поріг відповідно до визначення втручань високої цінності в рамках оцінки цінності Інституту клінічних та економічних оглядів [51]. Проте ми визнаємо, що різні зацікавлені сторони можуть мати різні порогові значення залежно від їхніх пріоритетів і ресурсів. Щоб врахувати цю мінливість, ми використали криві прийнятності економічної ефективності (CEAC), щоб дослідити ймовірність рентабельності Церебролізину в діапазоні потенційних порогових значень. CEAC допомагають особам, які приймають рішення, зрозуміти ймовірність того, що втручання буде економічно ефективним за різних порогових значень готовності платити, дозволяючи гнучкіше інтерпретувати результати залежно від контексту. Цей підхід допомагає передати невизначеність у нашому аналізі та дозволяє зацікавленим сторонам приймати обґрунтовані рішення на основі їхніх унікальних обставин і пріоритетів. Наш результат має бути інтерпретований проти цілей систем охорони здоров’я. Незважаючи на кілька спроб реформувати оцінку технологій охорони здоров’я [52], Румунія все ще використовує систему показників, засновану на оцінках інших країн [53]. Отже, державний платник не встановлює поріг економічної ефективності. Хоча попередні звіти Всесвітньої організації охорони здоров’я (WHO-CHOICE) припускали, що такі пороги можуть бути встановлені відповідно до валового внутрішнього продукту на душу населення, існує широка критика таких рекомендацій, оскільки вони не пов’язані з готовністю платити [54]. Незважаючи на те, що пріоритети в румунській системі охорони здоров’я та уподобання населення, пов’язані зі здоров’ям, є серйозним приводом для дискусій, ми стверджуємо, що сам поріг не має значення в контексті цього аналізу економічної ефективності на основі випробувань, оскільки приріст QALY недооцінений порівняно з хронічною фазою інсульту, яка настає після перших 90 днів. На питання, чи буде Церебролізин економічно ефективним у Румунії за протоколом CARS, усе ще важко відповісти через відсутність аналітичної моделі прийняття рішень, яка враховує довший період після інсульту. Однак цей аналіз прокладає шлях для майбутніх економічних оцінок Церебролізину в різних умовах, країнах і з різних інших точок зору. Він водночас доповнює доказову базу, яка буде використана для формування майбутніх стратегій, спрямованих на ефективне і стійке зменшення нині тяжкого соціального тягаря інсульту.
Список литературы
1. Feigin V.L., Stark B.A., Johnson C.O., Roth G.A., Bisignano C., Abady G.G. et al. Global, Regional, and National Burden of Stroke and Its Risk Factors, 1990-2019: A Systematic Analysis for the Global Burden of Disease Study 2019. Lancet Neurol. 2021. 20. 795-820. [CrossRef] [PubMed]
2. Foreman K.J., Marquez N., Dolgert A., Fukutaki K., Fullman N., McGaughey M. et al. Forecasting Life Expectancy, Years of Life Lost, and All-Cause and Cause-Specific Mortality for 250 Causes of Death: Reference and Alternative Scenarios for 2016–40 for 195 Countries and Territories. Lancet. 2018. 392. 2052-2090. [CrossRef]
3. Herpich F., Rincon F. Management of Acute Ischemic Stroke. Crit. Care Med. 2020. 48. 1654-1663. [CrossRef]
4. Stinear C.M., Lang C.E., Zeiler S., Byblow W.D. Advances and Challenges in Stroke Rehabilitation. Lancet. Neurol. 2020. 19. 348-360. [CrossRef]
5. Al-Jishi A., Saluja R.S., Al-Jehani H., Lamoureux J., Maleki M., Marcoux J. Primary or Secondary Decompressive Craniectomy: Different Indication and Outcome. Can. J. Neurol. Sci. 2011. 38. 612-620. [CrossRef] [PubMed]
6. Diener H.C., Rothwell P.M. Antithrombotic Drugs in Secondary Stroke Prevention: Still Some Way to Go. Lancet. 2022. 400. 974-975. [CrossRef] [PubMed]
7. Kalseth J., Halvorsen T. Health and Care Service Utilisation and Cost over the Life-Span: A Descriptive Analysis of Population Data. BMC Health Serv. Res. 2020. 20. 435. [CrossRef]
8. Jayawardana S., Cylus J., Mossialos E. It’s Not Ageing, Stupid: Why Population Ageing Won’t Bankrupt Health Systems. Eur. Heart J. Qual. Care Clin. Outcomes. 2019. 5. 195-201. [CrossRef]
9. Webb E., Hernandez-Quevedo C., Williams G., Scarpetti G., Reed S., Panteli D. Providing Health Services Effectively during the First Wave of COVID-19: A Cross-Country Comparison on Planning Services, Managing Cases, and Maintaining Essential Services. Health Policy. 2022. 126. 382-390. [CrossRef]
10. Winkelmann J., Webb E., Williams G.A., Hernandez-Quevedo C., Maier C.B., Panteli D. European Countries’ Responses in Ensuring Sufficient Physical Infrastructure and Workforce Capacity during the First COVID-19 Wave. Health Policy. 2022. 126. 362-372. [CrossRef]
11. Second Round of the National Pulse Survey on Continuity of Essential Health Services during the COVID-19 Pandemic. Available online: https://www.who.int/publications-detail-redirect/WHO-2019-nCoV-EHS-continuity-survey-2021.1 (accessed on 6 January 2022).
12. White T.G., Martinez G., Wang, J., Gribko M., Boltyenkov A., Arora R. еt al. Impact of the COVID-19 Pandemic on Acute Ischemic Stroke Presentation, Treatment, and Outcomes. Stroke Res. Treat. 2021. 2021. e8653396. [CrossRef] [PubMed]
13. Meza H.T., Lambea Gil A., Saldana A.S., Martinez-Zabaleta M., Juez P.D.L.R., Martinez E.L.C. еt al. Impact of COVID-19 Outbreak on Ischemic Stroke Admissions and in-Hospital Mortality in North-West Spain. Int. J. Stroke. 2020. 15. 755-762. [CrossRef] [PubMed]
14. Nogueira R.G., Qureshi M.M., Abdalkader M., Martins S.O., Yamagami H., Qiu Z. et al. Global Impact of COVID-19 on Stroke Care and IV Thrombolysis. Neurology. 2021. 96. e2824-e2838. [CrossRef]
15. Zhao J., Li H., Kung D., Fisher M., Shen Y., Liu R. Impact of the COVID-19 Epidemic on Stroke Care and Potential Solutions. Stroke. 2020. 51. 1996-2001. [CrossRef]
16. Nawabi N.L.A., Duey A.H., Kilgallon J.L., Jessurun C., Doucette J., Mekary R.A., Aziz-Sultan M.A. Effects of the COVID-19 Pandemic on Stroke Response Times: A Systematic Review and Meta-Analysis. J. NeuroInterv. Surg. 2022. 14. 642-649. [CrossRef]
17. The Territorial Impact of COVID-19: Managing the Crisis and Recovery across Levels of Government. Available online: https://www.oecd.org/coronavirus/policy-responses/the-territorial-impact-of-covid-19-managing-the-crisis-and-recovery-across-levels-of-government-a2c6abaf/ (accessed on 7 January 2022).
18. McKee M., Suhrcke M., Nolte E., Lessof S., Figueras J., Duran A., Menabde N. Health Systems, Health, and Wealth: A European Perspective. Lancet. 2009. 373. 349-351. [CrossRef] [PubMed]
19. Langhorne P., Ramachandra S. Stroke Unit Trialists’ Collaboration Organised Inpatient (Stroke Unit) Care for Stroke: Network Meta-Analysis. Cochrane Database Syst. Rev. 2020. 4. CD000197. [CrossRef]
20. Neumann P.J., Ganiats T.G., Russell L.B., Sanders G.D., Siegel J.E., Neumann P.J. еt al. (Eds.) Cost-Effectiveness in Health and Medicine, 2nd ed.; Oxford University Press: Oxford, UK. 2016. ISBN 978-0-19049293-9.
21. Drummond M.F., Sculpher M.J., Claxton K., Stoddart G.L., Torrance G.W. Methods for the Economic Evaluation of Health Care Programmes, 4th ed.; Oxford University Press: Oxford, UK. 2015. ISBN 978-0-19-966588-4.
22. Bettger J.P., Cadilhac D.A. Stroke Care Costs and Cost-Effectiveness to Inform Health Policy. Stroke. 2022. 53. 2078-2081. [CrossRef]
23. Beghi E., Binder H., Birle C., Bornstein N., Diserens K., Groppa S. et al. European Academy of Neurology and European Federation of Neurorehabilitation Societies Guideline on Pharmacological Support in Early Motor Rehabilitation after Acute Ischaemic Stroke. Eur. J. Neurology. 2021. 28. 2831-2845. [CrossRef]
24. Platz T. Rehabilitative Therapy for Arm Paresis Following a Stroke. 2020. Available online: https://www.awmf.org/leitlinien/detail/ll/080-001.html (accessed on 6 January 2022).
25. Teasell R., Hussein N., Mirkowski M., Vanderlaan D., Saika-ley M., Longval M., Iruthayarajah J. Stroke Rehabilitation Clinician Handbook; Evidence-Based Review of Stroke Rehabilitation: London, ON, Canada. 2020.
26. Muresanu D.F. Neuroplasticity and Neurorecovery. Stroke. 2009. 37-49. [CrossRef]
27. Strilciuc S. Safety of Cerebrolysin for Neurorecovery after Acute Ischemic Stroke: A Systematic Review and Meta-Analysis of Twelve Randomized-Controlled Trials. Pharmaceuticals. 2021. 14. 1297. [CrossRef] [PubMed]
28. Bornstein N.M., Guekht A., Vester J., Heiss W.-D., Gusev E., Homberg V. et al. Safety and Efficacy of Cerebrolysin in Early Post-Stroke Recovery: A Meta-Analysis of Nine Randomized Clinical Trials. Neurol. Sci. 2018. 39. 629-640. [CrossRef]
29. Alvarez X.A., Sampedro C., Figueroa J., Tellado I., Gonzalez A., Garda-Fantini M. et al. Reductions in QEEG Slowing over 1 Year and after Treatment with Cerebrolysin in Patients with Moderate-Severe Traumatic Brain Injury. J. Neural. Transm. 2008. 115. 683-692. [CrossRef]
30. Muresanu D.F., Florian S., Homberg V., Matula C., von Steinbuchel N., Vos, P.E. et al. Efficacy and Safety of Cerebrolysin in Neurorecovery after Moderate-Severe Traumatic Brain Injury: Results from the CAPTAIN II Trial. Neurol. Sci. 2020. 41. 1171-1181. [CrossRef]
31. Poon W., Matula C., Vos P.E., Muresanu D.F., von Steinbuchel N., von Wild K. et al. Safety and Efficacy of Cerebrolysin in Acute Brain Injury and Neurorecovery: CAPTAIN I — a Randomized, Placebo-Controlled, Double-Blind, Asian-Pacific Trial. Neurol. Sci. 2019. 41. 281-293. [CrossRef] [PubMed]
32. Kulikov A., Abdrashitova G. Cost-Effectiveness Analysis of Cerebrolysin In The Treatment of Patients With Acute Ischemic Stroke Moderate and Severe Degrees of Severity In The Russian Federation. Value Health. 2015. 18. A705. [CrossRef]
33. Walter E., Bauer M., Ressl S. Cost-Effectiveness Of Combined Treatment With Alteplase (Rt-Pa) And Cerebrolysin In Acute Ischemic Hemispheric Stroke In Austria. Value Health. 2015. 18. A390. [CrossRef]
34. Vladescu C., Scintee S.G., Olsavszky V., Hernandez-Quevedo C., Sagan A. Romania: Health System Review. Health Syst. Transit. 2016. 18. 1-170.
35. GDP per Capita (Current US$)—Romania, Data. Avai-lable online: https://data.worldbank.org/indicator/NY.GDP.PCAP.CD?locations=RO (accessed on 16 February 2022).
36. Muresanu D.F., Heiss W.-D., Hoemberg V., Bajenaru O., Popescu C.D., Vester J.C. et al. Cerebrolysin and Recovery After Stroke (CARS): A Randomized, Placebo-Controlled, Double-Blind, Multicenter Trial. Stroke. 2016. 47. 151-159. [CrossRef] [PubMed]
37. Calculating QALYs from the SF-36 and SF-12, Available from University of Sheffield. Available online: https://licensing.sheffield.ac.uk/product/SF-6D (accessed on 7 January 2022).
38. Bernhardt J., Hayward K.S., Kwakkel G., Ward N.S., Wolf S.L., Borschmann K. et al. Agreed Definitions and a Shared Vision for New Standards in Stroke Recovery Research: The Stroke Recovery and Rehabilitation Roundtable Taskforce. Int. J. Stroke. 2017. 12. 444-450. [CrossRef]
39. Mauskopf J.A., Sullivan S.D., Annemans L., Caro J., Mullins C.D., Nuijten M. et al. Principles of Good Practice for Budget Impact Analysis: Report of the ISPOR Task Force on Good Research Practices—Budget Impact Analysis. Value Health. 2007. 10. 336-347. [CrossRef] [PubMed]
40. Winstein C.J., Stein J., Arena R., Bates B., Cherney L.R., Cramer S.C. et al. Guidelines for Adult Stroke Rehabilitation and Recovery. Stroke. 2016. 47. e98-e169. [CrossRef]
41. Ringelstein E.B., Chamorro A., Kaste M., Langhorne P., Leys D., Lyrer P. et al. European Stroke Organisation Recommendations to Establish a Stroke Unit and Stroke Center. Stroke. 2013. 44. 828-840. [CrossRef]
42. Adiunea Prioritara Pentru Tratamentul Interventional Al Pacientilor Cu Avc Acut Procedura Operationala Standard Privind Traseul Pacientului Sti Protocolul Terapeutic; Romanian Society of Neurology: Bucharest, Romania, 2018.
43. Strilciuc S., Grad D.A., Mixich V., Stan A., Buzoianu A.D., Vladescu C., Vintan M.A. Societal Cost of Ischemic Stroke in Romania: Results from a Retrospective County-Level Study. Brain Sci. 2021. 11. 689. [CrossRef]
44. Norrving B., Barrick J., Davalos A., Dichgans M., Cordonnier C., Guekht A. et al. Action Plan for Stroke in Europe 2018-2030. Eur. Stroke J. 2018. 3. 309-336. [CrossRef] [PubMed]
45. Vester J., Bornstein N., Heiss W.-D., Vosko M., Moessler H., Jech M. et al. C-REGS 2—Design and Methodology of a High-Quality Comparative Effectiveness Observational Trial. J. Med. Life. 2021. 14. 700-709. [CrossRef] [PubMed]
46. Tiu C., Terecoasa E.O., Tuta S., Balasa R., Simu M., Sabau M. et al. Quality of Acute Stroke Care in Romania: Achievements and Gaps between 2017 and 2022. Eur. Stroke J. 2023. 8. 44-51. [CrossRef]
47. Lorenzovici L., Szekely A., Csanadi M., Gaal P. Cost Assessment of Inpatient Care Episodes of Stroke in Romania. Front. Public Health. 2020. 8. 605919. [CrossRef]
48. Strilciuc S., Grad D.A., Radu C., Chira D., Stan A., Ungureanu M., Gheorghe A., Muresanu F.-D. The Economic Burden of Stroke: A Systematic Review of Cost of Illness Studies. J. Med. Life. 2021. 14. 606-619. [CrossRef]
49. Thokala P., Ochalek J., Leech A.A., Tong T. Cost-Effectiveness Thresholds: The Past, the Present and the Future. Pharmacoeconomics. 2018. 36. 509-522. [CrossRef]
50. Wafa H.A., Wolfe C.D.A., Emmett E., Roth G.A., Johnson C.O., Wang Y. Burden of Stroke in Europe. Stroke. 2020. 51. 2418-2427. [CrossRef] [PubMed]
51. Value Assessment Framework. Available online: https://icer.org/our-approach/methods-process/value-assessment-framework/ (accessed on 12 April 2023).
52. Lopert R., Ruiz F., Gheorghe A., Chanturidze T. Technical Assistance for institution building of Health Technology Assessment structure, including training for the National Agency for Medicines & Medical Devices. In Situational Analysis of Romanian HTA; Romanian Ministry of Health: Bucharest, Romania, 2017.
53. Radu C.-P., Chiriac N.D., Pravat A.M. The Development of the Romanian Scorecard HTA System. Value Health Reg. Issues 2016. 10. 41-47. [CrossRef] [PubMed]
54. McDougall J.A., Furnback W.E., Wang B.C.M., Mahlich J. Understanding the Global Measurement of Willingness to Pay in Health. J. Mark. Access Health Policy. 2020. 8. 1717030. [CrossRef] [PubMed]
Уперше опубліковано:
Healthcare. 2023. 11. 1497.
https://doi.org/10.3390/healthcare11101497

/21.jpg)
/22.jpg)
/23.jpg)