Международный неврологический журнал Том 20, №2, 2024
Вернуться к номеру
Розвиткові та епілептиформні енцефалопатії в дітей: клінічні, нейрофізіологічні, нейровізуалізаційні й генетичні характеристики
Авторы: Кирилова Л.Г. (1), Мірошников О.О. (1), Юзва О.О. (1), Бадюк В.М. (2), Доленко О.О. (2), Бондаренко Ю.М. (1)
(1) - ДУ «Інститут педіатрії, акушерства і гінекології імені академіка О.М. Лук’янової НАМН України»,
м. Київ, Україна
(2) - Лабораторія генетичного аналізу ТОВ «Ультрагеном», м. Київ, Україна
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
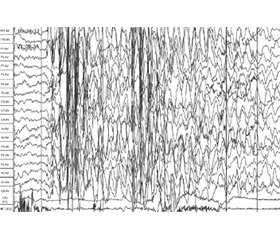
Мета: проаналізувати клінічні, нейрофізіологічні, нейровізуалізаційні й генетичні характеристики дітей раннього віку з епілептичними й розвитковими енцефалопатіями і визначити предиктори ризику розвитку розладів аутистичного спектра (РАС) у дітей даної групи з метою формування когорти дітей, які потребують динамічного спостереження і раннього втручання. Матеріали та методи. У дослідження було включено 38 дітей віком 0–3 роки з епілептиформними й розвитковими енцефалопатіями. Обстеження включало оцінку неврологічного статусу, збір анамнезу, оцінку семіології та визначення типу нападів, оцінку розвитку і скринінг розладів аутистичного спектра у віці 18 і 24 міс., відео-ЕЕГ-моніторинг під час нічного сну, магнітно-резонансну томографію головного мозку, скринінг на патогенні варіанти шляхом повноекзомного секвенування. Результати. Особливістю даної групи розладів є наявність безсудомних, часто клінічно нерозпізнаних епілептичних нападів, які проявляються персистуючою фокальною (60,5 %) або генералізованою (31,6 %) активністю із середнім (55,3 %) або високим (15,8 %) індексом спайк-хвильової активності під час стадії повільного сну та амплітудним акцентом над лобними (52,6 %) або скроневими (28,9 %) ділянками мозку. Структурні зміни головного мозку за даними магнітно-резонансної томографії виявлені в 91,1 % дітей, у тому числі вогнищеві або дифузні зміни білої речовині головного мозку — у 36,8 %, гіпоплазія мозолистого тіла — у 21,1 %, атрофічні зміни кори головного мозку відзначалися в 15,8 %, уроджені вади розвитку головного мозку — у 13,2 %. В обстежених дітей з початком нападів на першому році життя було виявлено патогенні варіанти 35 різних генів. Найчастіше зустрічалися патогенні варіанти генів, що відповідають за синтез і репарацію ДНК і РНК (28,9 %) та активність внутрішньоклітинних ферментів, — 8 дітей (21,1 %). Частка дітей, які мали загальну затримку розвитку у віці 24 міс., становила 11,9 %, а тих, які мали когнітивні порушення, — 34,2 %. Висновки. Показано, що в дітей з наявністю в анамнезі генералізованих тоніко-клонічних нападів (RR = 2,13) виявлено високий ризик розвитку РАС у 24 міс. Встановлено позитивний зв’язок між наявністю в дітей мутацій у генах, що відповідальні за синтез і репарацію ДНК (RR = 1,88), і підвищеним ризиком розвитку РАС у віці 24 міс. (90,9 % дітей).
Background. The purpose of the study to analyze the clinical, neurophysiological, neuroimaging and genetic characteristics of young children with developmental and epileptic encephalopathy and to determine risk predictors for the development of autism spectrum disorders, with the aim of forming a cohort of children in need of dynamic monitoring and early intervention. Materials and methods. Thirty-eight children aged 0–3 years with developmental and epileptic encephalopathy were included in the study. The examination included assessment of neurological status, history taking, assessment of semiology and determination of seizure type, assessment of development and screening for autism spectrum disorders at the age of 18 and 24 months, video-EEG monitoring during night sleep, magnetic resonance imaging of the brain, screening for pathogenic variants by whole exome sequen-cing. Results. A feature of this group of disorders is the presence of subtle, often unrecognized epileptic seizures, which are manifested by persistent focal (60.5 %) or generalized (31.6 %) activity with medium (55.3 %) or high (15.8 %) index of spike-and-wave activity during the stage of slow sleep and the amplitude emphasis over the frontal (52.6 %) or temporal (28.9 %) lobes. According to magnetic resonance imaging, structural changes in the brain were found in 91.1 % of children, including focal or diffuse changes in the white matter of the brain in 36.8 %, hypoplasia of the corpus callosum in 21.1 %, atrophic changes in the cerebral cortex in 15.8 %, congenital malformations in 13.2 % of cases. Pathogenic variants of 35 different genes were found in the examined children with the onset of seizures during the first year of life. Pathogenic variants of genes responsible for the synthesis and repair of DNA and RNA (28.9 %) and the activity of intracellular enzymes were the most common — 8 cases (21.1 %). The share of children with general developmental delay at the age of 24 months was 11.9 %, and cognitive impairment — 34.2 %. Conclusions. It was shown that children with a history of generalized tonic-clonic seizures (RR = 2.13) had a high risk of developing autism spectrum disorders at 24 months. A positive relationship was found between the presence of mutations in genes responsible for DNA synthesis and repair (RR = 1.88) and an increased risk of developing ASD at the age of 24 months (90.9 % of children).
діти; орфанні хвороби; епілептичні, епілептиформні й розвиткові енцефалопатії; розлади аутистичного спектра; когнітивні й поведінкові розлади; епілепсія; генетичні мутації; секвенування наступного покоління; електроенцефалографія; магнітно-резонансна томографія
children; orphan diseases; developmental and epileptic encephalopathy; autism spectrum disorders; cognitive and behavioral disorders; epilepsy; genetic mutations; next-generation sequencing; electroencephalography; magnetic resonance imaging