Международный неврологический журнал Том 20, №4, 2024
Вернуться к номеру
Лікування різних типів постампутаційного болю в резидуальній кінцівці в умовах повномасштабної війни
Авторы: I.S. Bohdan, A.I. Bohdan, Z.O. Plakhtyr
Military Medical Clinical Center of the Western Region, Lviv, Ukraine
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
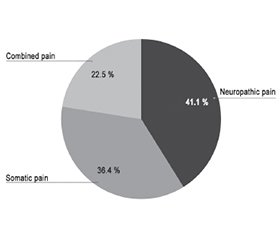
Актуальність. На постампутаційний біль страждають від 50 до 80 % військовослужбовців. Больовий синдром у куксі є вагомим фактором відтермінування протезування, недостатньо ефективної реабілітації пацієнта, затримки відновлення його працездатності й повернення до виконання службових обов’язків. Мета: вивчити типи постампутаційного болю в куксі серед військовослужбовців після травматичної ампутації та ефективність методів їх лікування. Матеріали та методи. Проведено рандомізоване крос-секційне дослідження 231 військово-службовця з больовим синдромом у резидуальній кінцівці після ампутацій внаслідок вогнепальних поранень, бойових травм, які проходили хірургічне лікування у військово-медичному клінічному центрі ІІІ–ІV рівня впродовж 2022–2024 років в умовах повномасштабної війни. Результати. У 36,36 % пацієнтів вибірки спостерігався соматичний біль у куксі, основною причиною якого була гетеротопічна осифікація (30,74 %). 41,13 % ампутантів мали нейропатичний тип болю внаслідок невром. У 22,51 % пацієнтів больовий синдром був викликаний як соматичними причинами, так і невромами. Протез-асоційований біль як різновид соматичного типу виявлений у 17,32 % осіб. У результаті цього дослідження встановлено, що персистенція чи рецидив нейропатичного болю серед пацієнтів групи, якій проводили лідокаїн-алкогольну ін’єкцію болючих невром, вірогідно нижчі (Pα = 0,013) через 6 місяців спостереження порівняно з групою після простих резекцій невром. Через 3 місяці після формування регенеративного периферичного неврального інтерфейсу (RPNI), виконаного при резекції 25 термінальних невром, рецидиву значущого болю не спостерігалось. Висновки. Важливо припускати у хворого з болем у куксі наявність одного чи обох типів болю: соматичного і/або нейропатичного. Прості резекції невром призводять до небажано високого рівня повторних операцій — 21,79 ± 4,86 % стійких болючих невром. З метою лікування нейропатичного болю, викликаного термінальними невромами, лідокаїн-алкогольні ін’єкції достатньо прості та ефективні (8,70 ± 3,26 % повторних втручань). Перспективною є методика RPNI для лікування і профілактики симптомних невром.
Background. Up to 50–80 % of military service members suffer from postamputation pain. Residual limb pain significantly postpones prosthetic surgery, recovery, employability, negatively impacts rehabilitation and military duty performance. The purpose was to study residual limb pain types in military personnel after traumatic amputation and efficacy of methods for their treatment. Materials and methods. A randomized cross-sectional study was performed of 231 military service members with residual limb pain after combat traumatic amputation, who underwent surgical treatment in tertiary and quaternary level military medical center between 2022 and 2024 amid full-scale war. Results. Somatic residual limb pain was observed in 36.36 % of enrolled patients, which was mainly caused by heterotopic ossification (30.74 %). 41.13 % of amputees experienced neuropathic pain due to neuromas. Pain syndrome in 22.51 % of patients resulted from both somatic causes and neuromas. Prosthesis-associated pain as a type of somatic pain was observed in 17.32 % of individuals. This study found that the persistence or recurrence of neuropathic pain among patients from the group of lidocaine-alcohol injection for painful neuromas was significantly lower (Pα = 0.013) at 6-month follow-up compared to the simple neuroma resection group. During 3 months after regenerative peripheral nerve interface, which was performed for 25 terminal neuromas, no pain recurrence was observed. Conclusions. It is important to assume the presence of one or both pain types in a patient with residual limb pain: somatic and/or neuropathic. Simple neuroma resections lead to an undesirably high reoperation rate — 21.79 ± 4.86 % of persistent painful neuromas. Lidocaine-alcohol injections are sufficiently simple and effective (8.70 ± 3.26 % of reinjections) in the treatment of neuropathic pain caused by terminal neuromas. Regenerative peripheral nerve interface is promising in the treatment and prevention of symptomatic neuroma.
постампутаційний біль; біль у резидуальній кінцівці; біль у куксі; симптомна неврома; гетеротопічна осифікація; резекція невром; лідокаїн-алкогольна ін’єкція; RPNI; протез-асоційований біль
postamputation pain; residual limb pain; stump pain; symptomatic neuroma; heterotopic ossification; neuroma resection; lidocaine-alcohol injection; regenerative peripheral nerve interface; prosthesis-associated pain