Вступ
Посттравматичний стресовий розлад (ПТСР) є серйозним психічним розладом, який може розвинутися у людей, що пережили травматичні події, як-от бойові дії [1]. У популяції військовослужбовців поширеність ПТСР може становити від 1,2 до 87,5 %, річна поширеність — від 6,7 до 50,2 %, а поширеність протягом життя — від 7,7 до 17 % [2]. Це свідчить про значущість проблеми ПТСР серед військовослужбовців, адже цей розлад має серйозний вплив на їхнє психічне здоров’я та якість життя, що потребує особливої уваги та розробки ефективних методів лікування [3, 4].
За останні 15 років було проведено багато досліджень щодо терапії ПТСР у військових. Проте навіть найефективніші існуючі методи, як-от індивідуальна травмофокусована терапія, не завжди доступні пацієнтам через обмежений доступ до підготовлених психотерапевтів та високу вартість лікування [5]. Методи експозиційної терапії також виявляють меншу ефективність у військових вибірках порівняно з цивільними [6].
Селективні інгібітори зворотного захоплення серотоніну (СІЗЗС) є першою лінією фармакотерапії ПТСР (зокрема, для пацієнтів з відсутністю належного доступу до травмофокусованої терапії) у багатьох клінічних настановах і показують статистично значуще зменшення симптомів ПТСР [5]. І хоча СІЗЗС, за результатами систематичних оглядів, є значущо кращими за плацебо у зменшенні симптомів ПТСР, розмір ефекту все одно досі залишається невеликим [7–9]. Окрім того, хоча СІЗЗС наразі є найпоширенішими препаратами, що призначаються військовослужбовцям із ПТСР, з роками спостерігається зменшення відсотка пацієнтів, які приймають ліки від ПТСР. На думку деяких авторів, це може відображати, зокрема, занепокоєння щодо ефективності та побічних ефектів від медикаментозного лікування [10].
Таким чином, існуючі методи лікування ПТСР, як-от фармакотерапія СІЗЗС та психотерапія, не завжди є ефективними для всіх пацієнтів. Пацієнти можуть не реагувати на стандартні методи лікування або відчувати сильні побічні ефекти, що спонукає до пошуку нових підходів до лікування ПТСР, які б були більш ефективними та переносимими [11, 12].
Антипсихотики, зокрема оланзапін, є перспективними як доповнююча терапія при ПТСР. Наразі існує невизначеність щодо настанов з фармакологічного лікування ПТСР — настанови Національного інституту досконалості охорони здоров’я та медичної допомоги (NICE) й Агентства з досліджень та якості у сфері охорони здоров’я (AHRQ) рекомендують використання антипсихотиків, як-от рисперидон, кветіапін та оланзапін, у терапії ПТСР [11, 13]. Водночас метааналіз 30 досліджень продемонстрував амбівалентні дані щодо ефективності комбінованої терапії ПТСР [8].
Попередні дослідження показали перспективність призначення антипсихотиків для впливу на стійкі симптоми ПТСР, зокрема на порушення сну [14, 15]. Хоча наразі чітких доказів щодо однозначної ефективності такої практики для військовослужбовців з ПТСР немає [14], результати метааналізу показали, що деякі атипові антипсихотики поліпшують лікування ПТСР, пов’язаного з бойовими діями, зокрема, що оланзапін підходить для ветеранів з надзвичайно тяжкими симптомами ПТСР [16]. Окрім того, при використанні антипсихотиків у популяції військовослужбовців з ПТСР не спостерігалося значущого збільшення кількості побічних реакцій на препарат [16]. Дослідження свідчать про можливість застосування оланзапіну для зменшення посттравматичних кошмарів [17] та поліпшення афективних симптомів у пацієнтів з ПТСР [18].
Однак досліджень щодо застосування антипсихотиків, зокрема оланзапіну, як додаткової терапії до СІЗЗС при ПТСР наразі мало, а рівень доказовості залишається невисоким [19]. Тому метою цього дослідження була оцінка ефективності та переносимості комбінованого прийому СІЗЗС та оланзапіну в дозуванні 2,5–5 мг порівняно з прийомом лише СІЗЗС у військовослужбовців з посттравматичним стресовим розладом.
Матеріали та методи
Досліджувана популяція. Дослідження схвалено локальним етичним комітетом і проведено за письмовою згодою всіх учасників відповідно до принципів біоетики, визначених Гельсінською декларацією «Етичні принципи медичних досліджень за участю людей» та Загальною декларацією про біоетику та права людини (ЮНЕСКО). У дослідженні взяли участь пацієнти чоловічої статі віком від 18 до 65 років з діагнозом «посттравматичний стресовий розлад», який встановлюється відповідно до Міжнародного класифікатора хвороб (МКХ-10, код діагнозу F43.1).
У дослідженні брали участь пацієнти, що відповідали наступним критеріям:
1. Військовослужбовці віком від 18 до 65 років.
2. Пацієнти з діагнозом: посттравматичний стресовий розлад (ПТСР) (F43.1 згідно з МКХ-10).
3. Загальний бал за шкалою PCL-5 ≥ 33.
4. Загальний бал за шкалою загального клінічного враження про тяжкість (CGI-S) ≥ 4 (помірно виражений розлад).
5. Тривалість симптомів ПТСР ≤ 6 місяців.
6. Згода пацієнта застосовувати надійні методи контрацепції в період дослідження.
7. Здатність пацієнта дотримуватись вимог протоколу.
8. Письмова інформована згода пацієнта на участь у дослідженні.
У дослідження не включалися пацієнти, які мали хоча б один з наступних критеріїв:
1. Відома гіперчутливість до будь-якого з компонентів досліджуваного препарату.
2. З моменту травматичної події минуло менше ніж місяць.
3. Психотичні розлади в анамнезі.
4. Епілепсія, судомні стани в анамнезі.
5. Пацієнти, в яких був встановлений первинний поточний діагноз: депресивний епізод (F32), дистимія (F34.1), обсесивно-компульсивний розлад (F42), генералізований тривожний розлад (F41.1), панічний розлад (F41.0), фобічні тривожні розлади (F40), біполярний афективний розлад (F31).
6. Ознаки іншої тяжкої супутньої патології, про яку відомо з анамнезу, фізикального огляду і лабораторного обстеження, яка, на думку дослідника, здатна вплинути на результати дослідження або перешкодити пацієнту закінчити дослідження.
7. АсАТ, АлАТ в 2 і більше рази перевищує верхню межу норми; загальний білірубін сироватки крові в 2 і більше рази перевищує верхню межу норми.
8. Пацієнти, які отримували препарати з психотропним компонентом, нейролептики, антидепресанти, анксіолітики, снодійні за 2 тижні до початку лікування.
9. Неможливість відмовитися від прийому алкоголю на період участі у дослідженні.
10. Наявна наркотична залежність.
11. Одночасна участь у будь-якому іншому клінічному дослідженні або участь у клінічному дослідженні протягом 3 місяців, що передують скринінгу.
Пацієнти мали бути виключені з дослідження при виникненні будь-якої із наступних ситуацій:
1. Відкликання інформованої згоди.
2. Помилкове включення пацієнта в дослідження (невідповідність критеріям включення/невключення) чи поява будь-якого критерію невключення в процесі дослідження.
3. Виникнення у пацієнта в ході дослідження серйозного та/або неочікуваного побічного явища або побічної реакції, що вимагає відміни досліджуваного препарату.
4. Значне погіршення загального стану пацієнта, що вимагає призначення забороненої в період дослідження терапії.
5. Розвиток серйозного інтеркурентного захворювання, яке потребує призначення супутньої терапії, яка, на думку дослідника, може вплинути на результати дослідження.
6. Недотримання пацієнтом режиму лікування або процедур, передбачених протоколом.
7. Втрата контакту з пацієнтом.
Дизайн і процедури дослідження. Це дослідження було подвійним рандомізованим контрольованим дослідженням ефективності та переносимості оланзапіну у схемі комбінованого лікування військовослужбовців з посттравматичним стресовим розладом.
Тривалість участі в дослідженні для кожного пацієнта становила 10 тижнів, з них:
— скринінг — до 14 днів. Скринінг міг тривати менше ніж 14 днів за умови дотримання пацієнтом відмови від застосування препаратів з психотропним компонентом, нейролептиків, антидепресантів, снодійних або анксіолітиків не менше ніж за 14 днів до рандомізації і початку лікування;
— лікування — 8 тижнів (56 днів).
Усі досліджувані методом простої рандомізації розподілялися в одну з двох груп: основну або контрольну. Основна група отримувала СІЗЗС та оланзапін (Адажио, 2,5 мг; 5 мг; АТ «Фармак») у дозуванні 2,5 мг/день (5 мг/день для курців) протягом 56 днів (8 тижнів), контрольна група отримувала лише СІЗЗС протягом 56 днів (8 тижнів). Окрім того, пацієнти могли приймати препарати, які постійно застосовують для лікування супутніх захворювань, крім тих, які заборонені протоколом. Також пацієнти в обох групах мали можливість проходити травмофокусовану психотерапію, а ще її окремі варіанти, як-от травмофокусована когнітивно-поведінкова психотерапія (КПТ), когнітивно-процесуальна психотерапія, КПТ з пролонгованою експозицією, наративна експозиційна психотерапія, а також десенсибілізація та переробка психічної травми рухами очей.
Під час дослідження пацієнти мали 7 візитів до лікаря.
— Візит 1 (дні 0–14) — скринінг, попередня оцінка відповідності пацієнта критеріям включення/невключення, відміна терапії, яку пацієнт приймав для лікування ПТСР, отримання даних лабораторних досліджень.
— Візит 2 — скринінг, оцінка відповідності пацієнта критеріям включення/невключення, рандомізація, призначення лікування.
— Візит 3 — 7-й день (1-й тиждень) лікування.
— Візит 4 — 14-й день (2-й тиждень) лікування.
— Візит 5 — 28-й день (4-й тиждень) лікування.
— Візит 6 — 42-й день (6-й тиждень) лікування.
— Візит 7 — 56-й день (8-й тиждень) — заключний.
Дні візитів могли бути зміщені на ± 3 дні з об’єктивних причин (якщо візит припадав на вихідний або святковий день).
На візиті 1 потенційному досліджуваному усно пояснювали умови дослідження, ознайомлювали з письмовою «Інформацією для пацієнта» та пропонували підписати форму інформованої згоди пацієнта на участь у дослідженні. Після підписання пацієнтом форми інформованої згоди проводились скринінгові процедури; тривалість скринінгу — до 14 днів. Скринінг міг тривати менше ніж 14 днів за умови дотримання пацієнтом відмови від застосування препаратів з психотропним компонентом, нейролептиків, снодійних або анксіолітиків не менше ніж за 14 днів до рандомізації і початку лікування.
Психодіагностичне оцінювання. Оцінка ефективності проводилась на підставі динаміки тяжкості ПТСР у процесі лікування (дні: 7, 14, 28,42 і 56-й), яка оцінювалася за допомогою таких психологічних шкал:
1. Опитувальник симптомів ПТСР (PCL-5).
2. Шкала загального клінічного враження, тяжкість захворювання (CGI-S).
3. Шкала загального клінічного враження, поліпшення (CGI-I).
4. Шкала оцінки порушень сну (PROMIS-SD).
5. Клінічна шкала тривоги Гамільтона (HAM-A).
Опитувальник симптомів ПТСР, що має добру внутрішню узгодженість (α = 0,94), надійність (r = 0,82), конвергентну (rs = 0,74–0,85) та дискримінантну (rs = 0,31–0,60) валідність, використовується для оцінки тяжкості симптомів ПТСР [20]. PCL-5 містить 20 тверджень, кожне з яких досліджуваний оцінює за 5-бальною шкалою від 0 (зовсім не турбувало) до 4 балів (дуже турбувало). Оцінки усіх тверджень надалі підсумовуються у загальний бал від 0 до 80. Симптоми ПТСР можна вважати клінічно значущими, якщо загальний бал за PCL-5 становить 33 бали і вище.
Шкали загального клінічного враження (CGI) є методиками вимірювання вираженості симптомів, відповіді на лікування та ефективності терапії в дослідженнях лікування пацієнтів з психічними розладами [21].
Шкала загального клінічного враження, тяжкість захворювання (CGI-S) — це 7-бальна шкала, яка вимагає від лікаря оцінити тяжкість захворювання пацієнта на даний момент порівняно з його минулим досвідом роботи з пацієнтами, які мають такий самий діагноз. Можливі варіанти відповідей: 0 — норма, не хворий; 1 — межовий стан; 2 — легкий ступінь захворювання; 3 — середня тяжкість захворювання; 4 — виражене захворювання; 5 — тяжке захворювання; 5 — належить до пацієнтів із найтяжчим ступенем захворювання [21].
Шкала загального клінічного враження, поліпшення (CGI-I) — це 7-бальна шкала, яка вимагає від лікаря оцінити, наскільки стан пацієнта поліпшився або погіршився порівняно з початковим станом. Можливі варіанти відповідей: 1 — дуже поліпшився; 2 — значно поліпшився; 3 — мінімально поліпшився; 4 — без змін; 5 — мінімально погіршився; 6 — значно погіршився; 7 — дуже сильно погіршився [21].
Шкала оцінювання інформації щодо повідомлених пацієнтом наслідків порушень сну (PROMIS-SD, Patient-Reported Outcomes Measurement Information System Sleep Disturbance) — шкала з 8 запитань про сон, кожне з яких оцінюється від 1 до 5 балів та підсумовується у загальний бал від 0 до 40. PROMIS-SD є надійною та валідною шкалою, яка дозволяє оцінити різні аспекти сну протягом минулого тижня [22].
Клінічна шкала тривоги Гамільтона (HAM-A), що відзначається валідністю та клінічною значущістю, використовується для клінічної оцінки та моніторингу різних розладів тривожності [23]. HAM-A охоплює широкий спектр психічних та соматичних симптомів тривоги та складається з 14 пунктів, кожен з яких оцінюється від 0 (відсутність симптому) до 4 балів (надзвичайна вираженість), які підсумовуються у загальний бал від 0 до 56.
Первинна кінцева точка: медіанна кількість балів за шкалою PCL-5.
Вторинні кінцеві точки:
— кількість та частка у відсотках пацієнтів у групах, у яких було досягнуто категорії «достатня ефективність»;
— кількість та частка у відсотках пацієнтів у групах, у яких було досягнуто поліпшення стану на 1 категорію і більше за шкалою CGI-S на 56-й день лікування;
— оцінка лікування дослідником за шкалою загального клінічного враження CGI-I на 56-й день лікування (8-й тиждень) характеризується як «значне поліпшення» або «виражене поліпшення»;
— середні значення загального бала за шкалою оцінки порушень сну (PROMIS-SD) на 0, 7, 14, 28, 42 і 56-й дні лікування в групах;
— кількість та частка у відсотках пацієнтів у групах, які відмовилися від подальшої участі в дослідженні у зв’язку з неефективністю лікування.
Розрахунок розміру вибірки. У попередніх дослідженнях автори зазначали 10 балів як маркер мінімальної клінічно значущої різниці між групами [24–27]. Таким чином, відповідно до цього консенсусу, різниця між групами в 10 або більше балів за PCL-5 була визначена як клінічно значуща. З урахуванням можливого вибуття пацієнтів у процесі дослідження, для оцінки різниці між групами у 10 балів при стандартному відхиленні 15 балів [20] загальна кількість пацієнтів має становити 96 пацієнтів (2 групи по 48 пацієнтів) для досягнення 90% потужності при p < 0,05.
Статистичний аналіз. Перевірка нормальності розподілу здійснювалась за допомогою тесту Шапіро — Уїлка. Описова статистика представлена у вигляді середнього значення та стандартного відхилення, а також першого, другого (медіани) та третього квартилів. Порівняння показників двох груп на кожній з часових точок відбувалося з використанням t-тесту для непов’язаних вибірок.
Додатково було побудовано лінійні регресійні моделі зі змішаними ефектами (інтерцепт та нахил згруповані для кожного пацієнта). Методом оцінки параметрів була обмежена максимальна правдоподібність (REML). Показник p < 0,05 було визначено як статистично значущий.
Для оцінки ймовірності появи побічних ефектів було побудовану криву виживаності Каплана — Мейєра з 95% довірчими інтервалами (ДІ).
Аналіз та візуалізація даних відбувались з використанням мови програмування python 3.12.1 у середовищі Microsoft Visual Code 1.90.1.
Результати
Дослідження проводилось із залученням 96 чоловіків-військовослужбовців віком 42,17 ± 10,10 року. Описова статистика результатів за шкалою PCL-5 та результати t-тестів наведено у табл. 1.
Кількість пацієнтів, у яких показник PCL-5 зменшився на 10 балів або більше, в обох групах був подібний (48,94 % — у групі контролю, 46,94 % — у групі дослідження). Таким чином, між групами не було виявлено різниці у загальному балі PCL-5 на кожній з часових точок. Пацієнти групи, що додатково прий-мала оланзапін, показали більш раптові зменшення симптомів посттравматичного стресу, тоді як пацієнти, що приймали виключно СІЗЗС, мали більш поступове зменшення симптомів, проте надалі різниця в динаміці між групами зменшилася (рис. 1).
Було виявлено статистично значущу різницю в інтенсивності розладів сну (загальний бал за PROMIS-SD) вже з першого тижня дослідження (табл. 2).
Таким чином, група, що приймала додатково оланзапін, вже з першого тижня дослідження мала меншу кількість проблем зі сном, ніж група, що приймала виключно СІЗЗС.
Найбільш значущою була різниця між групами у динаміці тривоги протягом часу — вже на 7-й день різниця була статистично значущою, і хоча протягом другого тижня дещо зменшилась, в подальшому залишалась статистично значущою (табл. 3).
Більш стрімке зниження тривожності під час додаткового прийому оланзапіну спостерігалось вже протягом першого тижня й надалі, тоді як у групі, що прий-мала лише СІЗЗС, після 42-го дня протитривожний ефект майже спинився (рис. 2).
Окрім того, лікарі при суб’єктивній оцінці стану пацієнтів оцінювали групу, що приймала оланзапін, як таку, що мала легші симптоми наприкінці дослідження та більш значне поліпшення (табл. 4).
Частка пацієнтів основної групи, у якій відбулося поліпшення на 1 або більше бал за CGI-S за 56 днів, становила 89,8 %, групи контролю — 72,3 %. Частка пацієнтів, у яких суб’єктивна оцінка лікарем їхньої динаміки (CGI-I) була визначена як «значно поліпшилося» або «більшою мірою поліпшилося», в основній групі становила 30,61 %, тоді як у групі порівняння — 19,15 %. Таким чином, лікарі частіше оцінювали пацієнтів, що додатково приймали оланзапін, як таких, що мають поліпшення.
Додатково до порівняння груп у всіх часових точках було побудовано лінійні моделі, щоб оцінити статистичну значущість між групами з плином часу, враховуючи індивідуальну дисперсію показників кожного пацієнта протягом 8 тижнів.
Лінійна модель посттравматичного стресу включала 576 спостережень з 6 часових точок, згрупованих по 96 пацієнтах. Аналіз лінійної регресії зі змішаними ефектами виявив статистично значуще зменшення загального бала за PCL із часом (у середньому –0,152 бала в день), проте відсутність статистично значущих відмінностей у динаміці посттравматичного стресу між групами (табл. 5).
Іншою виявилась динаміка тривожності. Аналіз лінійної регресії зі змішаними ефектами виявив статистично значуще зменшення загального бала за HAM-A із часом (у середньому –0,133 бала в день), а також статистично значущу відмінність у динаміці тривоги між групами (табл. 6).
Таким чином, хоча групи дещо відрізнялись за рівнем тривоги перед початком дослідження, використання лінійної регресії зі змішаними ефектами дозволило виявити значущу різницю між групами в динаміці тривоги — група пацієнтів, що приймала оланзапін додатково до СІЗЗС, показала більш стрімке зниження симптомів навіть після врахування індивідуальної варіативності під час аналізу.
Також було виявлено статистично значущі відмінності у динаміці розладів сну між двома групами — в обох групах спостерігався значущий ефект часу, що говорить про те, що проблеми зі сном зменшувались протягом часу, проте в групі, що додатково приймала оланзапін, зменшення симптомів відбувалося швидше (табл. 7).
Окрім того, спостерігалася тенденція до збільшення цієї різниці з часом, що дає підстави припускати можливість появи такої різниці під час подальшого спостереження (рис. 3).
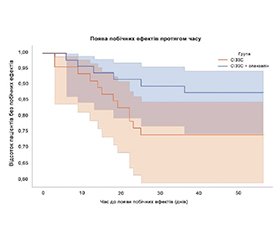
Аналіз кривих виживаності дозволив виявити, що поява побічних ефектів (в усіх зареєстрованих випадках це було почуття нудоти) в групі, що додатково приймала оланзапін, відзначалася у меншої кількості пацієнтів, що може підтверджувати протинудотну дію оланзапіну (рис. 4).
Отже, додатковий прийом оланзапіну також потенційно може зменшити побічну дію СІЗЗС навіть при швидкій титрації.
Обговорення
Таким чином, у нашому дослідженні аугментації оланзапіном стандартної фармакотерапії СІЗЗС військовослужбовців з ПТСР динаміка більшості симптомів основних кластерів ПТСР була порівнянною в обох групах. Хоча протягом першого тижня група, що додатково до СІЗЗС приймала оланзапін, мала більш стрімку редукцію симптомів тривоги та інсомнії, надалі різниця між групами залишалась незначущою. Отримані нами результати узгоджуються із повідомленнями інших дослідників, які зазначили, що антипсихотики другого покоління (рисперидон, кветіапін, оланзапін, арипіпразол) можна використовувати як монотерапію або як підсилювальну терапію у разі супутнього психозу або у випадку неефективності СІЗЗС/СІЗЗСН [28], втім, існують суперечливі докази того, що вони можуть бути ефективними при ПТСР, пов’язаному з бойовими діями, через відсутність істотної різниці між різними групами фармакотерапії за шкалою CAPS [29, 30].
Проявами ПТСР, на які оланзапін мав статистично значущий вплив, виявилися нічні кошмари та труднощі із засинанням. Так, у цьому дослідженні додавання оланзапіну зменшувало частоту та інтенсивність проблем зі сном вже в перший тиждень і надалі мало значущо кращий вплив на порушення сну, ніж монотерапія СІЗЗС. Інші дослідники також зазначають, що доповнення СІЗЗС оланзапіном може бути корисним для пацієнтів із хронічним безсонням та резистентними до лікування кошмарами, незважаючи на побічні ефекти, які можуть виникнути [30, 31].
Крім того, позитивний ефект аугментації оланзапіну на емоційний стан пацієнтів з ПТСР проявлявся в значущому зменшенні проявів тривоги з часом. Низка досліджень також підтверджує дозозалежну анксіолітичну дію оланзапіну, особливо при більш тривалому лікуванні [32]. До того ж у літературі наявні дані, що підтверджують перспективність використання атипових антипсихотиків, зокрема оланзапіну, у лікуванні генералізованого тривожного розладу, резистентного до впливу антидепресантів [33].
Дослідження аугментованої терапії ПТСР виявило, що додаткове лікування може бути найбільш корисним для пацієнтів, у яких спостерігається загострення симптомів ПТСР або супутні психічні розлади, що погіршують стан. Таким чином, використання оланзапіну у пацієнтів з коморбідним тривожним розладом виявляється доцільним.
Тривала терапія атиповими антипсихотиками може бути пов’язана з порушенням метаболізму. Так, оланзапін асоціювався з найбільшим погіршенням метаболічних профілів від року і більше після початку терапії, потім йшли рисперидон і кветіапін [34], але, на думку авторів, для деяких пацієнтів це може бути виправданою ціною стабілізації після травматичного досвіду або значно поліпшувати симптоми ПТСР. Саме тому відсутність зафіксованого протягом періоду дослідження збільшення маси тіла у пацієнтів, з яким зазвичай асоціюється прийом оланзапіну [35], викликає зацікавленість.
Дані мережевого метааналізу клінічної ефективності та прийнятності фармакотерапевтичних засобів згідно з настановою NICE щодо ПТСР, опубліковані 2023 року, зазначають переважну ефективність оланзапіну (87,6 %), пароксетину (82,2 %) та кветіапіну (77,0 %) в терапії ПТСР за шкалою CAPS. Кветіапін (84,1 %), пароксетин (77,9 %) та рисперидон (71,1 %) виявилися найкращим терапевтичним вибором для лікування симптомів повторного переживання. Оланзапін (92,6 %), пароксетин (84,3 %) та сертралін (68,1 %) були найбільш ефективними для лікування симптомів уникнення. Кветіапін (78,3 %), сертралін (69,9 %) та пароксетин (69,4 %) були найбільш ефективними в терапії симптомів підвищеного збудження. Оланзапін (88,6 %), кветіапін (81,2 %) та пароксетин (74,1 %) найбільш ефективні для лікування симптомів депресії, а рисперидон (93,7 %), зипразидон (71,0 %) і флуоксетин (58,4 %) — симптомів тривоги. Утім, кветіапін (91,1 %), циталопрам (68,8 %), венлафаксин (67,5 %), зипразидон (63,9 %) і флуоксетин (62,5 %) продемонстрували кращу прийнятність порівняно з арипіпразолом (11,8 %), рисперидоном (23,4 %), оланзапіном (31,0 %), сертраліном (34,2 %) та плацебо (44,4 %). За сукупною оцінкою ефективності та прийнятності автори цього дослідження підтвердили використання саме пароксетину, венлафаксину та кветіапіну як лікування першої лінії ПТСР [36]. Саме низький рівень прийнятності оланзапіну через клінічно значуще (≥ 7 %) збільшення маси тіла як побічний ефект тривалої терапії [37] обумовив його відсутність серед препаратів першої лінії терапії ПТСР попри переважну ефективність за шкалою CAPS, а також редукцію симптомів уникнення та депресії.
Отримані в нашому дослідженні результати не підтверджують докази на користь значного збільшення маси тіла, це може бути пояснено призначенням низьких доз (2,5 мг та 5 мг), а також відносно недовготривалим періодом прийому препарату, протягом якого вплив оланзапіну на метаболізм (який є добре вивченим та описаним у літературі) міг не розвинутись. Разом з тим це наштовхує на думку щодо можливості короткотривалого доповнення фармакотерапії ПТСР оланзапіном, протягом якого спостерігатиметься позитивний вплив на сон та тривогу, але не метаболічний ефект.
Окрім того, ми звернули увагу на протинудотну дію оланзапіну, що було підтверджено відсутністю зареєстрованих випадків відчуття нудоти на початку терапії СІЗЗС у групі комбінованої терапії, а також на загалом краще суб’єктивне враження лікарів від стану пацієнтів, що пройшли аугментовану терапію.
Таким чином, попри відсутність значущого впливу від додавання оланзапіну до терапії СІЗЗС на перебіг ПТСР, від аугментованої терапії є користь у вигляді зменшення порушень сну та тяжкості тривоги, а також потенційного протинудотного впливу оланзапіну, що дозволить зменшити негативні ефекти від прийому СІЗЗС.
Сильні сторони дослідження включають його рандомізований контрольований дизайн, який забезпечує високий рівень надійності та мінімізує ризик упередженості. Крім того, ретельний відбір пацієнтів і суворе дотримання критеріїв включення та виключення дозволяють отримати точні дані про ефективність та безпеку оланзапіну в специфічній популяції військово-службовців з ПТСР. Використання різних валідованих психодіагностичних шкал, як-от PCL-5, CGI-S, CGI-I, PROMIS-SD і HAM-A, дозволяє провести детальний аналіз впливу лікування на різні аспекти ПТСР, зокрема на симптоматику, тривогу і порушення сну. Систематичний підхід до аналізу даних, включаючи лінійні регресійні моделі та криві виживаності, підсилює вірогідність отриманих результатів.
Разом з тим обмеження цього дослідження включають кілька аспектів, які можуть вплинути на його результати та інтерпретацію. По-перше, обмеження вибірки лише військовослужбовцями може зменшити загальну застосовність результатів до ширшої популяції пацієнтів з ПТСР. По-друге, відносно короткий період спостереження (8 тижнів) не дає можливості брати до уваги довгострокову ефективність та переносимість лікування. Крім того, виключення пацієнтів із супутніми психічними розладами та певними фізичними станами може призвести до деякої однорідності вибірки, що може не відображати реальної клінічної картини. Використання самозвітних інструментів, як-от PCL-5, може бути суб’єктивним і впливати на точність даних.
Висновки
Дослідження виявило, що додавання оланзапіну (Адажио, 2,5 мг; 5 мг; АТ «Фармак») до схеми лікування СІЗЗС у військовослужбовців, які страждають на ПТСР, вплинуло на динаміку зменшення симптомів тривоги та розладів сну. Незважаючи на загальне зменшення балів ПТСР в обох групах із часом, різниці між групами не було виявлено у жодній з часових точок. Лінійний регресійний аналіз зі змішаними ефектами підтвердив ці результати, показавши відсутність значущих відмінностей у динаміці зменшення симптомів ПТСР між групами, хоча загальний рівень симптомів ПТСР зменшувався із часом.
Щодо інтенсивності розладів сну, вже починаючи з першого тижня група, яка отримувала оланзапін додатково до СІЗЗС, демонструвала статистично значущо меншу кількість проблем зі сном. Лінійний аналіз зі змішаними ефектами виявив значущу різницю в динаміці розладів сну між групами, окрім того, підтвердив загальне поліпшення сну з часом в обох групах. Це свідчить про те, що додаткове застосування оланзапіну має позитивний вплив на сон.
Найбільш значущі результати були отримані щодо динаміки тривожності. Група, яка приймала оланзапін, демонструвала більш стрімке зниження симптомів тривоги вже з 7-го дня дослідження. Лінійний аналіз зі змішаними ефектами підтвердив статистично значущу різницю між групами, показавши, що група з оланзапіном мала швидше зниження рівня тривожності. Це підкреслює потенційну користь оланзапіну як доповнення до СІЗЗС для більш ефективного зниження тривожності у військовослужбовців з ПТСР.
Таким чином, додавання оланзапіну до стандартного лікування СІЗЗС може бути корисним для швидшого зниження тривожності та поліпшення сну у пацієнтів з ПТСР. Це може допомогти у розробці більш ефективних схем лікування, що зменшують тягар розладу для пацієнтів та поліпшують їх якість життя.
Перспективи подальших досліджень включають необхідність триваліших спостережень для оцінки довгострокових ефектів оланзапіну у лікуванні ПТСР. Додатково варто проводити дослідження на різних популяціях пацієнтів, що може дозволити в подальшому розробити рекомендації для персоналізованої медицини.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Інформація про фінансування. Немає фінансування. Дослідження проводилося в рамках клініко-наукової роботи кафедри медичної психології, психосоматичної медицини та психотерапії Навчально-наукового інституту психічного здоров’я Національного медичного університету імені О.О. Богомольця.
Інформація про внесок кожного автора. Хаустова О.О. — концепція, дизайн дослідження, збирання, обробка та аналіз матеріалів, фінальне редагування; Мухаровська І.Р. — аналіз отриманих даних, технічне редагування тексту.
Отримано/Received 11.07.2024
Рецензовано/Revised 20.08.2024
Прийнято до друку/Accepted 22.08.2024
Список литературы
1. Eshel Y., Kimhi S., Marciano H., Adini B. Predictors of PTSD and Psychological Distress Symptoms of Ukraine Civilians During war. Disaster Med Public Health Prep. 2023. № 17. doi: 10.1017/dmp.2023.69. PMID: 37435730.
2. Prevalence of post-traumatic stress disorder in the United States: a systematic literature review. J. Schein, C. Houle, A. Urganus et al. Curr Med Res Opin. 2021. Vol. 37(12). P. 2151-2161. doi: 10.1080/03007995.2021.1978417.
3. Chaban O.S., Bezsheyko V.H., Khaustova O.O., Burlaka O.V., Ryvak T.B., Kyrylyuk S.S. Gender-related differences of stress reactions in Ukrainian combatants. Pharmacia. 2018. № 65(2). Р. 3-10.
4. Чабан О.С., Хаустова О.О. Медико-психологічні наслідки дистресу війни в Україні: що ми очікуємо та що потрібно враховувати при наданні медичної допомоги. Український медичний часопис. 2022. Т. 4. С. 150. doi.org/10.32471/umj.1680-3051.150.232297.
5. Schrader C., Ross A. A Review of PTSD and Current Treatment Strategies. Mo Med. 2021. Vol. 118(6). P. 546-551.
6. McLean C.P., Levy H.C., Miller M.L., Tolin D.F. Exposure therapy for PTSD: A meta-analysis. Clin Psychol Rev. 2022. Vol. 91. Р. 102115. doi: 10.1016/j.cpr.2021.102115.
7. Martin A., Naunton M., Kosari S., Peterson G., Thomas J., Christenson J.K. Treatment Guidelines for PTSD: A Systematic Review. J Clin Med. 2021. Vol. 15. Issue 10(18). P. 4175. doi: 10.3390/jcm10184175.
8. Pharmacological therapy for post-traumatic stress disorder: a systematic review and meta-analysis of monotherapy, augmentation and head-to-head approaches. M.D. Hoskins, J. Bridges, R. Sinnerton et al. Eur J Psychotraumatol. 2021. Vol. 26. Issue 12(1). P. 1802920. doi: 10.1080/20008198.2020.1802920.
9. Pharmacotherapy for post-traumatic stress disorder: syste-matic review and meta-analysis. M. Hoskins, J. Pearce, A. Bethell et al. Br J Psychiatry. 2015. Vol. 206(2). P. 93-100. doi: 10.1192/bjp.bp.114.148551.
10. Trends in Medication Prescribing in Patients With PTSD From 2009 to 2018: A National Veterans Administration Study. N. Holder, A. Woods, T.C. Neylan et al. J Clin Psychiatry. 2021. Vol. 4. Issue 82(3). P. 20m13522. doi: 10.4088/JCP.20m13522.
11. Moore B.A., Pujol L., Waltman S., Shearer D.S. Management of Post-traumatic Stress Disorder in Veterans and Military Service Members: A Review of Pharmacologic and Psychotherapeutic Interventions Since 2016. Curr Psychiatry Rep. 2021. Vol. 6. Issue 23(2). P. 9. doi: 10.1007/s11920-020-01220-w.
12. Randomized Controlled Trial of Riluzole Augmentation for Posttraumatic Stress Disorder: Efficacy of a Glutamatergic Modulator for Antidepressant-Resistant Symptoms. P.T. Spangler, J.C. West, C.L. Dempsey et al. J Clin Psychiatry. 2020. Vol. 27. Issue 81(6). P. 20m13233. doi: 10.4088/JCP.20m13233.
13. Forman-Hoffman V., Middleton J.C., Feltner C. et al. Psychological and Pharmacological Treatments for Adults with Posttraumatic Stress Disorder: A Systematic Review Update [Internet]. Rockville (MD): Agency for Healthcare Research and Quality (US); 2018. Report No.: 18-EHC011-EFReport No.: 2018-SR-01.
14. Pharmacotherapy for sleep disturbances in post-traumatic stress disorder (PTSD): A network meta-analysis. A.S. Lappas, E. Glarou, Z.A. Polyzopoulou et al. Sleep Med. 2024. Vol. 119. P. 467-479. doi: 10.1016/j.sleep.2024.05.032.
15. Lappas A.S., Polyzopoulou Z.A., Christodoulou N., Bozikas V.P., Samara M.T. Effects of Antidepressants on Sleep in Post-traumatic stress disorder: An Overview of Reviews. Curr Neuropharmacol. 2024. Vol. 22(4). P. 749-805. doi: 10.2174/1570159X21666230801144328.
16. Effectiveness, Acceptability and Safety of Pharmaceutical Management for Combat-Related PTSD in Adults Based on Syste-matic Review of Twenty-Two Randomized Controlled Trials. J.Z. Yan, J.L. Liu, X.Z. Li et al. Front Pharmacol. 2022. Vol. 18. Issue 12. P. 805354. doi: 10.3389/fphar.2021.805354.
17. Geldenhuys C., van den Heuvel L.L., Steyn P., Seedat S. Pharmacological Management of Nightmares Associated with Posttraumatic Stress Disorder. CNS Drugs. 2022. Vol. 36(7). P. 721-737. doi: 10.1007/s40263-022-00929-x.
18. Jerotić S., Ivković M. Pharmacological treatment of treatment-resistant depression: Towards evidence-based recommendations. Medicinska istraživanja. 2024. Vol. 57(1). P. 59-66. doi: 10.5937/medi57-48086.
19. Rossi R., Niolu C., Siracusano A., Rossi A., Di Lorenzo G. A Case of Comorbid PTSD and Posttraumatic OCD Treated with Sertraline-Aripiprazole Augmentation. Case Rep Psychiatry. 2020. Vol. 27. P. 2020:2616492. doi: 10.1155/2020/2616492.
20. Blevins C.A., Weathers F.W., Davis M.T., Witte T.K., Do-mino J.L. The Posttraumatic Stress Disorder Checklist for DSM-5 (PCL-5): Development and Initial Psychometric Evaluation. J Trauma Stress. 2015. Vol. 28(6). P. 489-98. doi: 10.1002/jts.22059.
21. Guy W. Clinical Global Impressions Scale. In ECDEU Assessment Manual for Psychopharmacology. 1976. Р. 217-222. National Institute of Mental Health.
22. Development of short forms from the PROMIS™ sleep disturbance and Sleep-Related Impairment item banks. L. Yu, D.J. Buysse, A. Germain et al. Behav Sleep Med. 2011. Vol. 28. Issue 10(1). P. 6-24. doi: 10.1080/15402002.2012.636266.
23. Hamilton M. The assessment of anxiety states by rating. British Journal of Medical Psychology. 1959. Vol. 32(1). P. 50-55. https://doi.org/10.1111/j.2044-8341.1959.tb00467.x.
24. Minimal important difference metrics and test-retest reliabi-lity of the PTSD Checklist for DSM-5 with a primary care sample. B.E. Blanchard, M. Johnson, S.B. Campbell et al. J Trauma Stress. 2023. Vol. 36(6). P. 1102-1114. doi: 10.1002/jts.22975.
25. Efficacy of a Therapist-Assisted Self-Help Internet-Based Intervention Targeting PTSD, Depression, and Insomnia Symptoms After a Disaster: A Randomized Controlled Trial. G. Belleville, M.C. Ouellet, V. Békés et al. Behav Ther. 2023. Vol. 54(2). P. 230-246. doi: 10.1016/j.beth.2022.08.004.
26. Psychometric properties of the PTSD Checklist for Diagnostic and Statistical Manual of Mental Disorders-Fifth Edition (PCL-5) in veterans. M.J. Bovin, B.P. Marx, F.W. Weathers et al. Psychol Assess. 2016. Vol. 28(11). P. 1379-1391. doi: 10.1037/pas0000254.
27. Weathers F.W., Litz B.T., Keane T.M., Palmieri P.A., Marx B.P., Schnurr P.P. 2013. The PTSD Checklist for DSM-5 (PCL-5). Scale available from the National Center for PTSD at www.ptsd.va.gov.
28. Al Jowf G.I., Ahmed Z.T., Reijnders R.A., de Nijs L., Eijssen L.M.T. To Predict, Prevent, and Manage Post-Traumatic Stress Disorder (PTSD): A Review of Pathophysiology, Treatment, and Biomarkers. Int J Mol Sci. 2023. Vol. 9. Issue 24(6). P. 5238. doi: 10.3390/ijms24065238.
29. Trauma-coerced attachment and complex PTSD: Informed care for survivors of human trafficking. R. Chambers, M. Gibson, S. Chaffin et al. Journal of Human Trafficking. 2024. Vol. 10(1). P. 41-50. doi: 10.1080/23322705.2021.2012386.
30. Quetiapine Add-On Therapy May Improve Persistent Sleep Disturbances in Patients with PTSD on Stabile Combined SSRI and Benzodiazepine Combination: A One-Group Pretest-Posttest Study. M. Vilibić, V. Peitl, M. Živković et al. Psychiatr Danub. 2022. Vol. 34(2). P. 245-252. doi: 10.24869/psyd.2022.245.
31. Carey P., Suliman S., Ganesan K., Seedat S., Stein D.J. Olanzapine monotherapy in posttraumatic stress disorder: Efficacy in a randomized, double-blind, placebo-controlled study. Hum. Psychopharmacol. 2012. № 27. Р. 386-391. doi: 10.1002/hup.2238.
32. Lockington M.R., Hughes R.N. Effects of olanzapine on an-xiety-related behaviour in male and female rats assessed after 21-24 and 42-45 days of chronic treatment. Behav Pharmacol. 2021. Vol. 32(2&3). P. 194-211. doi: 10.1097/FBP.0000000000000612.
33. Ansara E.D. Management of treatment-resistant generalized anxiety disorder. Ment Health Clin. 2020. Vol. 10(6). P. 326-334. doi: 10.9740/mhc.2020.11.326.
34. Cohen B., Maguen S., Seal K., Neylan T. Comparing Medications Added to a Serotonin Reuptake Inhibitor to Treat Patients with PTSD [Internet]. Washington (DC): Patient-Centered Outcomes Research Institute (PCORI); 2021. https://doi.org/10.25302/05.2021.cer.150731834.
35. Olsson K. Posttraumatic Stress Disorder and the US Military Veteran Population. 2021. Available from: https://digitalworks.union.edu/steinmetzsymposium/steinmetz_2021/posters/39/
36. Clinical outcomes of recommended active pharmacotherapy agents from NICE guideline for post-traumatic stress disorder: Network meta-analysis. Prog Neuropsychopharmacol. Z.X. Zhang, R.B. Liu, J. Zhang et al. Biol Psychiatry. 2023. Vol. 13. Issue 125. Р. 110754. doi: 10.1016/j.pnpbp.2023.110754.
37. Metabolic adverse effects of off-label use of second-generation antipsychotics in the adult population: a systematic review and meta-analysis. N. Stogios, E. Smith, S. Bowden et al. Neuropsychopharmacology. 2022. № 47(3). Р. 664-672. doi: 10.1038/s41386-021-01163-7.

/31.jpg)
/32.jpg)
/34.jpg)
/33.jpg)