Международный неврологический журнал Том 21, №4, 2025
Вернуться к номеру
Реабілітація пацієнтів при сенсомоторних порушеннях: керівництво щодо діагностики та лікування захворювань нервової системи (вибрані розділи)
Рубрики: Неврология
Разделы: Руководства
Версия для печати
Координатори: проф., д-р Gereon Nelles, Кельн; проф., д-р Thomas Platz, Грайфсвальд
Опубліковано Комісією з розробки керівництв Німецького товариства неврології (DGN) і Німецького товариства з нейрореабілітації (DGNR) за участю професійних товариств, асоціацій та організацій, що беруть участь у процесі досягнення консенсусу.
Що нового?
— Пластичність — це здатність нейронних мереж, зокрема центральної нервової системи (ЦНС), адаптуватися до умов навколишнього середовища. У реабілітації враховуються дві форми нейропластичності: процеси адаптації після захворювання або травми, тобто так звана пластичність, спричинена ураженням, і пластичність, спричинена лікуванням і тренуванням («пластичність, заснована на досвіді»).
— Відновлення головного мозку після лікування засноване, зокрема, на досить специфічному та інтенсивному відновлювальному тренуванні («терапія для відновлення нервової системи»), що підтримує церебральну реорганізацію. Цьому може сприяти неінвазивна стимуляція кори головного мозку та (деякі) лікарські засоби.
— Реабілітація при сенсомоторних порушеннях входить у програму нейрореабілітації за показаннями (також для лікування інших функціональних розладів, що порушують повсякденну діяльність) і здійснюється з індивідуальною часовою перспективою («каскад лікування»), що включає заходи (часткової) стаціонарної (ранньої) реабілітації, а також для подальшого амбулаторного лікування, самостійного тренування і спортивної реабілітації. При цьому вона передбачає (з урахуванням мети лікування) підхід до відновлення функцій (на рівні порушення, для відновлення активності) для сприяння активності. З іншого боку, реабілітаційні заходи також включають тренування для відновлення повсякденної діяльності, а також соціальну і професійну активність (включно з тренуванням з використанням допоміжних засобів для сприяння такій активності). Враховуються екологічні й індивідуальні фактори.
— Родичі пацієнтів, які можуть залежати від допомоги (наприклад, після виписки з лікарні), можуть навчитися самодопомозі під час зміни положення, ходьби та іншої повсякденної діяльності в центрах підтримки. Це суттєво впливає на якість життя пацієнтів та їхніх родичів.
— Організована професійна допомога при інсульті (включно з реабілітацією) не лише знижує рівень смертності, ризик тривалої госпіталізації та тривалої втрати працездатності, а й покращує відновлення і незалежність у повсякденній діяльності. Реабілітація при сенсомоторних порушеннях стає в нагоді.
— У перші тижні після інсульту спостерігається фаза посиленої нейропластичності, що триває кілька тижнів, під час якої відбувається найбільше покращання діапазону рухів. Мета підтримуючого медикаментозного лікування — подовжити цю фазу і/або посилити нейропластичні процеси протягом цієї фази. Селективний інгібітор зворотного захоплення серотоніну (СІЗЗС) флуоксетин не впливає на ступінь інвалідності після інсульту, але може бути ефективним у покращанні рухливості. Церебролізин® — це суміш ферментативно оброблених пептидів, отриманих з мозку свині, що має нейропротекторні та нейротрофічні властивості в експериментах на тваринах. Церебролізин® може полегшувати неврологічний розлад і втрату працездатності в пацієнтів після інсульту, а в комбінації з реабілітацією може покращити рухливість, особливо в пацієнтів із серйозним порушенням.
— Зі збільшенням кількості пацієнтів, які вижили після серцево-легеневої реанімації, зростає й кількість супутніх ускладнень, зокрема гіпоксичного ураження головного мозку. На відміну від вогнищевого ураження головного мозку після інсульту глобальна ішемія головного мозку при зупинці серця, як правило, призводить до ураження тих ділянок головного мозку, що є найменш толерантними до ішемії. Сюди входить, зокрема, ділянка гіпокампа. Увага приділяється не стільки сенсомоторним, скільки когнітивним порушенням, особливо короткочасної та довготривалої пам’яті (а також розладам свідомості). Реабілітацію при сенсомоторних порушеннях необхідно адаптувати до когнітивних здібностей конкретного пацієнта. У принципі сенсорно-
моторні здібності до навчання і потенціал для відновлення можливі навіть у разі серйозних когнітивних порушень.
— Незважаючи на зниження частоти нещасних випадків і технологічний прогрес у їхній профілактиці, черепно-мозкова травма (ЧМТ) є однією з головних проблем у сфері неврологічної реабілітації. Люди похилого віку все частіше стикаються з ЧМТ та ушкодженнями мозку в результаті падінь. При ЧМТ порушення когнітивних і виконавчих функцій з порушенням поведінки та контролем над імпульсами нерідко відіграють важливу роль у реабілітації. Тому когнітивно-поведінкова терапія часто є невід’ємною частиною лікування. Реабілітацію при сенсомоторних порушеннях адаптують до індивідуальних особливостей.
— Сенсомоторні порушення є поширеними наслідками пухлин головного мозку та їх лікування. Тип та обсяг реабілітаційних заходів залежать від неврологічного розладу та очікуваної відповіді пухлини на лікування. Реабілітацію часто інтегрують в нейроонкологічне лікування пухлини.
— Розлади та форми перебігу захворювання в пацієнтів із розсіяним склерозом (РС) суттєво відрізняються, а мінливість є більшою, ніж при ішемічному інсульті із захворюваннями судин і відповідними станами. При РС захворювання часто прогресує через дегенеративні та/або дифузні запальні процеси, навіть без рецидивів або появи нових вогнищ. Ще однією відмінністю від інсульту є частота та інтенсивність втоми. Реабілітація при сенсомоторних порушеннях є невід’ємною частиною належного лікування РС. Основними критеріями успішної реабілітації також є тренування, регулярні фізичні вправи та корекція способу життя.
— Нервово-м’язові захворювання (НМЗ) — це не-однорідна група захворювань, що вражають переважно периферичну нервову систему. Вони спричиняються ураженням нервів, нервово-м’язової передачі, м’язів або їхньою комбінацією. Центральна, сенсорна або вегетативна нервова система та інші системи органів також можуть уражатись. Особливістю усіх НМЗ є атрофія м’язів. Вона може призвести до слабкості дихальних м’язів, м’язів ротової порожнини, тулуба та кінцівок, а також до обмежень у повсякденній діяльності (ПД) та інвалідності. НМЗ включають гострі, підгострі та, зокрема, хронічні захворювання, тому важливо продовжувати лікування сенсомоторних порушень не лише в стаціонарному, а й в амбулаторному відділенні, а також реабілітацію в стаціонарі, наприклад у рамках конкретної процедури. Важливо забезпечити безперервне лікування.
2. Особливості набутих ушкоджень головного мозку
Gereon Nelles, Elke Pucks-Faes, Thomas Platz
2.1. Реабілітація при сенсомоторних порушеннях як невід’ємна частина неврологічної (ранньої) реабілітації
Сенсомоторні порушення разом з іншими сенсорними, когнітивними та комунікаційними розладами сприяють інвалідності при набутому ураженні головного мозку. За відсутності прогресуючого ураження, наприклад у разі прогресуючої пухлини головного мозку, сенсомоторні порушення регресують, принаймні протягом тривалого часу, і частково, доки спостерігаються органічні передумови, такі як часткова цілісність кортикоспінальних шляхів (Bernhardt та співавт., 2017). Цьому можуть сприяти як спонтанне одужання, так і покращання функції головного мозку після лікування. Функціональне відновлення головного мозку після лікування засновано, зокрема, на досить специфічному й інтенсивному відновлювальному тренуванні («терапія для відновлення нервової системи»; Joy та Carmichael, 2021), що підтримує церебральну реорганізацію. З іншого боку, цьому може сприяти неінвазивна стимуляція кори головного мозку і (деякі) лікарські засоби (див. розділ 10 «Медикаментозне лікування в рамках фізичної реабілітації»). Реабілітація при сенсомоторних порушеннях входить у програму нейрореабілітації за показаннями (також для лікування інших функціональних розладів, що порушують повсякденну діяльність) і здійснюється з індивідуальною часовою перспективою («каскад лікування») (Bernhardt та співавт., 2017), що включає заходи (часткової) стаціонарної (ранньої) реабілітації, а також для подальшого амбулаторного лікування, самостійного тренування та спортивної реабілітації. При цьому вона передбачає (з урахуванням мети лікування) підхід до відновлення функцій (на рівні порушення, для відновлення активності) для сприяння активності. Враховуються екологічні й індивідуальні фактори.
Поетапне впровадження нейрореабілітації, засноване на фазовій моделі Федерального товариства реабілітації (BAR, 1995), пропонує великий асортимент реабілітаційних заходів і центрів. Відповідно до цієї моделі, встановленої в Німеччині, невідкладне лікування (наприклад, в інсультному відділенні) відповідає фазі A. Перехід від фази A до фази B, C або D, як правило, пов’язаний зі зміною медичного закладу. Рання неврологічна реабілітація є фазою лікування і реабілітації В і залежно від тяжкості інсульту характеризується високою потребою в (інтенсивному або) невідкладному лікуванні. У фазі C пацієнти можуть проходити активну реабілітацію, але все ще можуть потребувати догляду. Фаза D відповідає заключному етапу реабілітації (постгоспітальна реабілітація) після завершення раннього підвищення рухової активності. У фазі E відбувається професійна реабілітація. У фазі F для пацієнтів із серйозним ураженням застосовують тривалі підтримуючі й функціональні заходи. У Швейцарії та Австрії були створені інші індивідуальні форми догляду, що забезпечують догляд відповідно до тяжкості порушень і «каскад лікування».
/8.jpg)
2.2. Реабілітація при сенсомоторних порушеннях після інсульту
Сенсомоторні порушення, особливо геміпарез, є найпоширенішими неврологічними розладами після ураження ЦНС. У понад 50 % усіх пацієнтів після інсульту спостерігається залишковий парез, особливо верхньої кінцівки (руки та кисті). Тому в дорослих геміпарез при інсульті є найпоширенішою причиною інвалідності. Понад 2/3 пацієнтів після інсульту потребують подальшого курсу реабілітаційного лікування після гострої фази, приблизно 1/3 все ще залежать від сторонньої допомоги в повсякденній діяльності, 20 % потребують допомоги з пересуванням, а 70 % залишаються обмеженими щодо здатності працювати (Buntin та співавт., 2010). У більшості випадків полегшення неврологічного розладу спостерігається протягом періоду від кількох тижнів до кількох місяців після гострого захворювання. Це відновлення є дуже мінливим, але повне відновлення досягається рідко. Вік і ступінь тяжкості геміпарезу є найважливішими предикторами відновлення (Harvey, 2015). При інсульті ранні клінічні ознаки відновлення (протягом перших 7 днів), такі як активне розгинання кисті та пальців або відведення в плечовому суглобі паретичної кінцівки, мають прогностичне значення для тривалого відновлення; нейрофізіологічні параметри, такі як магнітні викликані потенціали (МВП), і біомаркери візуалізації, такі як дифузійно-зважена МРТ, також можуть сприяти оцінці потенціалу для відновлення (Stinear, 2017). У пацієнтів з виключно моторними порушеннями («чистий моторний геміпарез»), доброю пропріоцепцією та когнітивною функцією часто добрі шанси на відновлення, навіть якщо спостерігається гостра фаза тяжкого (неповного) геміпарезу.
Відновлення після порушень чутливості вивчено недостатньо. Порушення чутливості можуть викликати незначні або тяжкі функціональні розлади. Зокрема, порушення глибокої чутливості часто суттєво впливають на моторику й порушують такі важливі функції, як хапання і ходьба. Між моторними й сенсорними порушеннями (з урахуванням застосування кінцівки) існує тісний взаємозв’язок.
В інсультних відділеннях і під час подальшої післягострої реабілітації лікування проводить багатопрофесійна команда, що включає лікарів, медсестер, фізіотерапевтів, ерготерапевтів, логопедів, нейропсихологів і соціальних працівників; за необхідності сюди входять реабілітологи. Метааналіз, проведений Співпрацею дослідників інсультного відділення, свідчить про важливість раннього початку реабілітації — у момент, коли пацієнт буде фізично готовий до неї (Langhorne та спів-авт., 2020). Існують переконливі метааналітичні докази багатьох рандомізованих контрольованих досліджень, які демонструють, що організована багатопрофесійна допомога при інсульті (включно з реабілітацією) не лише знижує рівень смерті (співвідношення шансів (СШ) 0,76, 95% довірчий інтервал (ДІ) 0,66–0,88; докази середньої якості) та ризик тривалої госпіталізації та втрати працездатності, а й підвищує шанси на відновлення і незалежність у повсякденній діяльності (СШ 0,77, 95% ДІ 0,69–0,87; докази середньої якості) (Langhorne та співавт., 2020). Ефективність окремих методів і технік реабілітації, що сприяють загальному успіху, розглядається в розділах 7–11 цього керівництва.
/8_2.jpg)
Час та інтенсивність ранньої реабілітації також є важливими факторами ефективності після інсульту. Найбільший рівень відновлення після неврологічного розладу, особливо сенсомоторних функцій, спостерігається протягом перших 3–6 місяців після інсульту (van der Vliet та співавт., 2020). Після цього крива відновлення стає більш плоскою. При незначних порушеннях частіше спостерігається більш швидке відновлення (протягом перших 3 місяців), тоді як при тяжких — повільніше відновлення, причому крива вирівнюється лише через 6 місяців. Тому інтенсивна реабілітація є ефективнішою протягом перших 3–6 місяців після інсульту. Відповідно ранній початок інтенсивної реабілітації після сенсомоторних порушень рекомендується в багатьох міжнародних клінічних керівництвах (наприклад, Platz та співавт., 2021). Однак протягом першої доби після гострого інсульту можлива підвищена чутливість. У великому багатоцентровому дослідженні за участю понад 2100 пацієнтів висока інтенсивність і раннє підвищення рухової активності протягом першої доби після інсульту були пов’язані з гіршою ефективністю (Співпраця щодо дослідження AVERT, 2015).
Важливим компонентом реабілітації при сенсомоторних порушеннях після інсульту є застосування допоміжних засобів для тренування рухливості, навичок самодопомоги та активності. Перша медична допомога, як правило, надається до завершення реабілітації в стаціонарі, а потім за необхідності здійснюється амбулаторно залежно від ходу лікування.
/9.jpg)
Реабілітаційні заходи, що надаються амбулаторно після виписки після фази D, сприяють подальшому відновленню. Амбулаторна реабілітація, як правило, проводиться за допомогою рецептурних лікарських засобів. Їх необхідно додатково адаптувати в загальний план лікування. Пізніше плануються регулярні фази або навіть фази більш інтенсивної реабілітації при сенсомоторних порушеннях за показаннями. Цілі лікування та втручання обираються індивідуально, а успішність заходів перевіряється за допомогою стандартизованих оцінок. Тривалість постгоспітальної реабілітації при сенсомоторних порушеннях залежить від таких факторів, як тип і ступінь тяжкості неврологічного розладу, реабілітаційного потенціалу, успіху призначеного лікування, а також факторів соціального контексту. Для успішної амбулаторної реабілітації необхідно формулювати чіткі цілі реабілітації. У пацієнтів із залишковим неврологічним розладом, наприклад геміпарезом, продовження амбулаторної реабілітації також може відновити рухливість і здатність до самодопомоги. Однак дані наукових досліджень про це відсутні.
/9_2.jpg)
2.3. Реабілітація після гіпоксичного ураження головного мозку
Зі збільшенням кількості пацієнтів, які вижили після серцево-легеневої реанімації, зростає й кількість супутніх ускладнень, зокрема гіпоксичного ураження головного мозку. На відміну від вогнищевого ураження головного мозку після інсульту глобальна ішемія головного мозку при зупинці серця, як правило, призводить до ураження тих ділянок головного мозку, що є найменш толерантними до ішемії. Сюди входить, зокрема, ділянка гіпокампа. Увага приділяється не стільки сенсомоторним, скільки когнітивним порушенням, особливо короткочасної та довготривалої пам’яті (а також розладам свідомості). Дані проспективних контрольованих досліджень ефективності реабілітаційних заходів відсутні. У ретроспективному дослідженні за участю 152 пацієнтів спостерігалось покращання когнітивних здібностей під час стаціонарного реабілітаційного лікування (Stock та співавт., 2016). Інше ретроспективне дослідження за участю 93 пацієнтів продемонструвало, що тривала рання неврологічна реабілітація багатьох порушень (навички ПД) на початку реабілітації іноді супроводжується суттєвим покращанням повсякденної діяльності (Heinz та Rollnik, 2015). Реабілітацію при сенсомоторних порушеннях необхідно адаптувати до когнітивних здібностей конкретного пацієнта. У принципі сенсорно-
моторні здібності до навчання та потенціал для відновлення можливі навіть у разі серйозних когнітивних порушень.
/9_3.jpg)
2.4. Реабілітація після черепно-мозкової травми
Незважаючи на зниження частоти нещасних випадків і технологічний прогрес у їхній профілактиці, черепно-мозкова травма є однією з головних проблем у сфері неврологічної реабілітації. Люди похилого віку все частіше стикаються з ЧМТ та ушкодженнями головного мозку в результаті падінь. Багаторівнева допомога на основі фазової моделі Федерального товариства реабілітації також може бути застосована до лікування ЧМТ. На всіх етапах реабілітації лікування необхідно проводити відповідно до єдиної програми лікування багатопрофесійною командою, що включає лікарів, медсестер, фізіотерапевтів, ерготерапевтів, логопедів, нейропсихологів і соціальних працівників; за необхідності сюди входять реабілітологи. Реабілітація після черепно-мозкової травми враховує три основних підходи:
1) нейропластичності сприяють реабілітаційні заходи;
2) виявлення ускладнень і запобігання їм під час (часткової) реабілітації в стаціонарі протягом періоду від кількох днів до кількох місяців після черепно-мозкової травми;
3) адаптація до допоміжних засобів здійснюється в рамках реабілітації для відповідного покращання навичок повсякденної діяльності (Platz, 2021).
Існують обмежені дані контрольованих досліджень щодо ефективності індивідуальних технік реабілітації, структурованих програм лікування або оптимальних періодів реабілітації після ЧМТ. Основними рекомендаціями щодо реабілітації після ЧМТ є навчальні програми, тренування за допомогою комп’ютера, тренування навичок повсякденної діяльності, безпечне застосування допоміжних засобів, а також навчання й консультування щодо зміни поведінки (Lee та співавт., 2019). Через лобно-скроневу здатність до контузій головного мозку при ЧМТ порушення когнітивних і виконавчих функцій з порушенням поведінки та контролем над імпульсами відіграють важливу роль у реабілітації після ЧМТ. Тому когнітивно-поведінкова терапія часто є невід’ємною частиною лікування. Реабілітація після поширених сенсомоторних порушень проводиться з урахуванням індивідуальних особливостей і часто характеризується реабілітаційним потенціалом, що зберігається протягом тривалого часу. У невеликому контрольованому дослідженні за участю пацієнтів з тяжкою черепно-мозковою травмою відновлення було кращим після раннього лікування порівняно з пацієнтами, які отримували лікування пізніше (Andelic та співавт., 2012).
/10.jpg)
2.5. Реабілітація після пухлини головного мозку
Сенсомоторні порушення є поширеними наслідками пухлин головного мозку та їх лікування. Тип та обсяг реабілітаційних заходів залежать від неврологічного розладу й очікуваної відповіді пухлини на лікування. Реабілітацію часто інтегрують в нейроонкологічне лікування пухлини. Основна увага приділяється заходам для полегшення сенсомоторних порушень, комунікативних і нейропсихологічних розладів, а також підтримці в опрацюванні психологічних причин захворювання та емоційного стану. Докази ефективності таких заходів ще не підтверджені в дослідженнях, хоча менші контрольовані дослідження вказують на необхідність міждисциплінарної інтенсивної реабілітації пацієнтів із пухлиною головного мозку, що покращує рухливість, здатність контролювати сечовипускання і здатність до самодопомоги в повсякденній діяльності (Khan та співавт., 2014). Рандомізовані контрольовані дослідження організації (стаціонарне й амбулаторне лікування), інтенсивності й тривалості лікування, а також ефективності витрат також відсутні.
/10_2.jpg)
2.6. Реабілітація після енцефаліту
Крім нейропсихологічного розладу, сенсомоторні порушення є поширеними причинами інвалідності після енцефаліту. Основна увага приділяється заходам, що полегшують ці порушення. Дані контрольованих досліджень ефективності індивідуальних методів реабілітації або структурованих програм лікування відсутні.
/10_3.jpg)
5. Особливості рухових розладів
Niels Allert
5.1. Реабілітація при сенсомоторних порушеннях і при хворобі Паркінсона
Хвороба Паркінсона — це нейродегенеративне захворювання з прогресуючим розвитком рухових та інших розладів. Прогресування захворювання не можна ні затримати, ні зупинити. Динаміка захворювання й поєднання рухових та інших розладів є неоднорідними. Тому цілі реабілітації визначаються індивідуально та змінюються у міру прогресування захворювання. Залежно від порушення призначаються фізичні, фармакологічні та хірургічні методи лікування. Тому міждисциплінарна змішана реабілітація враховує всі методи лікування й індивідуальні комбінації для покращання успіху лікування. Змішаний терапевтичний підхід також застосовується через взаємодію між руховими та іншими розладами. Наприклад, нелікована депресія, нелікований психоз або марення знижують успіх лікування за допомогою фізіотерапевтичних вправ, як і нелікована ортостатична дисрегуляція або нелікований нейрогенний сечовий міхур.
/11.jpg)
Інші розлади враховуються під час реабілітації рухових розладів, об’єктивізуються за допомогою відповідних оцінок (наприклад, шкала оцінки немоторних проявів хвороби Паркінсона, Storch та співавт., 2010) і лікуються за показаннями.
Специфічні рухові розлади при хворобі Паркінсона включають акінезію, ригідність, тремор, порушення координації рухів і рівноваги, включно з поставою. Для планування реабілітації відповідно до Міжнародної класифікації функціонування, обмеження життєдіяльності та здоров’я (МКФ) наявність і тяжкість цих розладів, а також вплив на самостійність у повсякденній діяльності реєструються за допомогою відповідних оцінок.
Оцінки при хворобі Паркінсона
— Шкала Hoehn та Yahr надає класифікацію 5 стадій захворювання (Hoehn та Yahr, 1967).
— Уніфікована шкала оцінки хвороби Паркінсона (UPDRS), зокрема розділи II і III, дозволяє оцінити тяжкість рухових симптомів захворювання та їхній вплив на повсякденну діяльність (Fahn та Elton, 1987).
— Шкала оцінки повсякденної діяльності Schwab та England оцінює самостійність у повсякденній діяльності (Schwab та England, 1969).
Для отримання інформації про реабілітацію/лікування порушень мовлення, пов’язаних із хворобою Паркінсона, див. керівництво DGN «Нейрогенні розлади мовлення (дизартрія)» (Ackermann та співавт., 2018).
Важливу роль у лікуванні рухових розладів відіграє медикаментозне лікування. Це враховано в концепції реабілітації та застосовується відповідно до керівництв (керівництво S3 «Хвороба Паркінсона» було чинним до 31.12.2020 і на сьогодні переглядається). Подібним чином, коли медикаментозне лікування обмежене, враховується ескалаційна терапія у вигляді помпової терапії (підшкірна інфузія апоморфіну, кишкова інфузія леводопи) або хірургічного втручання (глибока стимуляція мозку, таламотомія, палідотомія, фокусоване ультразвукове лікування під контролем МРТ). Для цього може потребуватись оцінка в спеціальних медичних закладах.
Лікування акінетично-ригідних порушень функції верхніх кінцівок розглядається в окремому розділі керівництва про порушення функції верхній кінцівок (див. розділ 7.4 «Специфічне лікування»). На цьому етапі порушення ходьби та рівноваги розглядаються, зокрема, як рухові розлади.
Ходьба може зазнати змін при хворобі Паркінсона. Гіпокінетична хода характеризується меншою довжиною кроку, меншим рухом стопи з основним навантаженням на передню частину стопи, зменшеним розмахом рук і швидкістю ходьби. Навантаження на передню частину стопи може збільшуватися під час ходьби і призводити до фестинації та порушувати здатність швидко зупинитись. Збільшується кількість кроків для повороту. Блокування ходьби («застигання при ходьбі») можливе на початку, при повороті, у вузьких місцях, до досягнення пункту призначення або спонтанно під час ходьби. Під час перебігу захворювання також можуть порушитися рефлекси рівноваги. Етапи компенсації, коли зміщення центру ваги занадто малі, посилюють етапи коригування і призводять до падіння.
Для оцінки ходьби та рівноваги застосовуються такі оцінки:
— тест із 6-хвилинною ходьбою;
— тест на проходження 10 метрів;
— визначення параметрів ходьби, таких як швидкість ходьби та довжина кроку;
— тест «Встань та іди»;
— тест на відновлення рівноваги після поштовху;
— шкала рівноваги Берга;
— Mini-BESTest (системи оцінки мінібалансу);
— опитувальник застигання при ходьбі для оцінки блокування ходьби (застигання при ходьбі) (німецька версія: Vogler та співавт., 2015).
Рухові розлади, включно з порушеннями координації рухів і рівноваги, можна полегшити за рахунок фізичних вправ і фізіотерапії. Останнім часом зросла кількість наукових доказів. Було створено європейське керівництво щодо фізіотерапії хвороби Паркінсона в рамках комплексного аналізу даних (Keus та співавт., 2014). Це керівництво востаннє оновлювали у 2020 році, туди було включено результати 191 дослідження за участю 7998 пацієнтів (Radder та співавт., 2020).
Було виділено окремі форми лікування. Наведено клінічні параметри, для яких відповідна форма лікування призвела до суттєвого покращання в метааналізі, а також рекомендації, отримані авторами з досліджень щодо тривалості сеансів, частоти й тривалості лікування (Keus та співавт., 2014; Radder та співавт., 2022). У нещодавніх метааналізах конкретних методів лікування додатково наведено ці результати (станом на жовтень 2022 р.). Однак порівняти різні форми лікування на основі доказів неможливо.
— Стандартна фізіотерапія полегшила загальні рухові симптоми, покращила ходьбу, знизила ризик падіння та блокування ходьби. Рекомендована періодичність — 3 рази на тиждень по 45 хвилин протягом принаймні 8 тижнів.
— Тренування на біговій доріжці покращило ходьбу (особливо швидкість ходьби й довжину кроку), але не вплинуло на блокування ходьби. Рекомендована періодичність — 3 рази на тиждень по 30 хвилин протягом принаймні 4 тижнів. У метааналізі 13 досліджень Bishnoi та співавт. (2022) спостерігалось збільшення довжини кроку під час тренувань лише на біговій доріжці. Тренування на біговій доріжці зі збільшенням швидкості або нахилу покращило швидкість ходьби, довжину кроку і темп; тренування на біговій доріжці з відхиленням покращило швидкість ходьби та довжину кроку.
— Стратегічне тренування покращило ходьбу і рівновагу, але не вплинуло на блокування ходьби.
— Танці полегшили загальні рухові симптоми, покращили ходьбу і рівновагу, але не вплинули на блокування ходьби. Рекомендована періодичність — 2 рази на тиждень по 60 хвилин протягом принаймні 10 тижнів. Hasan та співавт. виявили метааналіз 14 рандомізованих конт-рольованих досліджень за участю 372 пацієнтів, у яких спостерігались суттєві полегшення загальних рухових симптомів, покращання ходьби і рівноваги (Hasan та співавт., 2022). Досліджувались різні форми танців (танго, ірландські танці, сардинські танці, бальні танці, латиноамериканські танці та туро). Найчастіше досліджувалось (аргентинське) танго. Танго підходить найбільше через часті періоди початку та зупинки руху, а також зміни швидкості та ритму.
— Тай-чі (та цигун) полегшило загальні рухові симптоми, покращило ходьбу та рівновагу. Рекомендована періодичність — 2 рази на тиждень по 60 хвилин протягом принаймні 24 тижнів. Yu та співавт. також виявили ефективність у полегшенні рухових симптомів, брадикінезії та покращанні рівноваги в метааналізі 17 рандомізованих контрольованих досліджень за участю 951 пацієнта (Yu та співавт., 2021), Lei та співавт. — в іншому метааналізі 20 рандомізованих контрольованих досліджень за участю 996 пацієнтів (Lei та співавт., 2022). Lei та співавт. також вивчали відмінності між різними формами тай-чі. За сукупністю рухових симптомів найефективнішими виявились: 24 форми спрощеного тай-чі > програма вправ тай-чі > 8 форм спрощеного тай-чі в стилі Ян > 8 форм спрощеного тай-чі в стилі Чень. З точки зору рівноваги найефективнішими виявились: програма вправ тай-чі > 24 форми спрощеного тай-чі > 8 форм спрощеного тай-чі в стилі Чень.
— Скандинавська ходьба полегшила загальні рухові симптоми, покращила ходьбу і рівновагу. Salse-Batn та співавт. у своєму метааналізі 12 рандомізованих конт–рольованих досліджень виявили, що клінічно значущим було лише покращання здатності до ходьби, але не зміни загальних рухових симптомів і рівноваги (Salse-Batn та співавт., 2022).
— Силові тренування покращили ходьбу. Однак у 2022 році Yang та співавт. у метааналізі 14 досліджень за участю 761 пацієнта виявили покращання блокування ходьби та м’язової сили, але не інших параметрів ходьби або рівноваги (Yang та співавт., 2022). Gollan та співавт. проаналізували 18 рандомізованих контрольованих досліджень і виявили суттєве покращання м’язової сили, полегшення загальних рухових симптомів, покращання ходьби та рівноваги порівняно з пасивною контрольною групою, але не порівняно з активною контрольною групою (Gollan та співавт., 2022).
— Аеробне тренування полегшило загальні рухові симптоми, покращило ходьбу і рівновагу. І навпаки, Li та співавт. у метааналізі 9 рандомізованих контрольованих досліджень за участю 444 пацієнтів виявили покращання ходьби та рівноваги, але не полегшення рухових симптомів (Li та співавт., 2021).
— Тренування ходьби та рівноваги полегшило загальні рухові симптоми, покращило ходьбу і рівновагу. Ефективність лікувальної фізкультури для запобігання/зменшення падінь досліджувалася в кокранівському аналізі (Allen та співавт., 2022). Після цієї лікувальної фізкультури зменшилася частота падінь на 26 %, а кількість пацієнтів, які зазнали одного або кількох падінь, — на 10 %. На ранніх стадіях захворювання доцільним було регулярне самостійне тренування під наглядом; на пізніх стадіях захворювання (через підвищений ризик падінь) фізіотерапія була достатньою (Platz та Lempert, 2022).
— Фітнес-ігри (комп’ютерні ігри, що стимулюють рухи та реакції) покращили ходьбу і рівновагу. Sarasso та співавт. також виявили покращання рівноваги завдяки тренуванню рівноваги на основі віртуальної реальності в метааналізі (Sarasso та співавт., 2022), але виключно після тренування і без доведених тривалих ефектів. Zhang та співавт. у метааналізі 19 досліджень за участю 781 пацієнта вивчали ефективність фітнес-ігор у людей похилого віку з хворобою Паркінсона. Також було виявлено суттєві покращання індивідуальних параметрів ходьби, але вони не були клінічно значущими (Zhan та співавт., 2022).
/12.jpg)
Специфічні рухові розлади
Тремор
Тремор може виникати у стані спокою і/або у вигляді постурального тремору, а також тремору дії, особливо у верхніх кінцівках. Тремор у стані спокою є предметом стигматизації, але він спричиняє менше хвилювань, ніж постуральний тремор або тремор дії. Медикаментозне лікування є стандартом лікування (див. керівництво S2k Німецького товариства неврології, Deuschl та співавт., 2022). У разі недостатньої відповіді або небажаних явищ медикаментозного лікування призначається хірургічне втручання (процедури щодо ураження, такі як таламотомія та палідотомія, процедури без ураження, такі як глибока стимуляція мозку), а також нехірургічні втручання (фокусована ультразвукова абляція під контролем МРТ). Можливі переваги й ризики необхідно визначати на індивідуальній основі в спеціальних медичних закладах під час встановлення показань.
На сьогодні на користь ефективності лікування тремору за допомогою рухових вправ виступають лише обмежені докази (O’Connor та Kini, 2011; Fox та співавт., 2018; Kadkhodaie та співавт., 2020; Shahien та співавт., 2022).
/13.jpg)
Порушення постави
Характерні порушення постави при хворобі Паркінсона включають передній нахил хребта з тяжкою формою камптокормії, бічне відхилення хребта з тяжкою формою синдрому Пізи та згинання шийного відділу хребта з тяжкою формою антеколісу (Tinazzi та співавт., 2022). Етіологія ще недостатньо досліджена (Srivanitchapoom та Hallet, 2016). Обговорюються центральні й периферичні механізми, особливо центральні дистонічні й периферичні міопатичні механізми. Запропоновані методи лікування відрізняються. Докази їхньої ефективності на сьогодні обмежені, тому загальні рекомендації відсутні. В окремих випадках ефективними можуть бути:
— фізіотерапія з вправами на розтяжку і зміцненням постуральних м’язів (Gandolfi та співавт., 2019);
— ботулотоксин (Artusi та співавт., 2019) за наявності ознак дистонічного порушення;
— ортопедичні операції на хребті (Spindler та співавт., 2016; Kimura та співавт., 2017; Park та співавт., 2020);
— глибока стимуляція мозку в субталамічному ядрі або внутрішньому блідому шарі (Spindler та співавт., 2022).
Як допоміжний засіб часто рекомендуються ролятори з опорою для передпліччя для кращого контролю за поставою під час стояння та ходьби.
/13_2.jpg)
Блокування ходьби (застигання при ходьбі)
Блокування ходьби є дуже тяжким руховим розладом. Воно може виникати на початку, при повороті, у вузьких місцях, до досягнення пункту призначення або спонтанно під час ходьби. Воно пов’язане з підвищеним ризиком падінь, особливо за наявності додаткових порушень рівноваги. Рекомендації щодо лікування, засновані на сильних доказах, поки що відсутні (Goh та співавт., 2022; Kwok та співавт., 2022). Goh та співавт. не виявили чітких доказів ефективності реабілітації в метааналізі 65 рандомізованих досліджень (Goh та співавт., 2022). Вони рекомендують індивідуальну терапію, засновану на основних факторах, разом з лікуванням для покращання ходьби та рівноваги. І навпаки, Kwok та співавт. у метааналізі 46 рандомізованих контрольованих досліджень (Kwok та співавт., 2022) надають докази ефективності таких методів лікування:
— тренування з подоланням перешкод;
— тренування зі спостереженням за діями (ТСД);
— тренування на біговій доріжці;
— комплексна лікувальна фізкультура.
З цього автори роблять висновок, що комплексне рухове тренування з вправами на уважність і когнітивні навички є багатообіцяючим.
Важливими в лікуванні блокування ходьби є зовнішні візуальні та слухові стимули («підказки»), що можуть долати блокування. Отже, можна застосовувати візуальні стимули, такі як спроєктована лазерна лінія на підлозі, наприклад, направлена на милиці або ролятори. Плескання в долоні або голосна розмова можуть бути ефективними. Такі стимули також можуть надавати асистенти (Ghai та співавт., 2018).
Стандартні ролятори часто виявляються неефективними в разі блокування ходьби, оскільки вони котяться у момент блокування ходьби та можуть підвищувати ризик падіння. Ролятори з гальмівним механізмом (ролятори з реверсивним гальмом, ролятори з відцентровим гальмом) є корисною альтернативою.
/13_3.jpg)
6. Реабілітація для сприяння активності
Stephanie Reichl, Klemens Fheodoroff , Sabine Brinkmann
Реабілітація при сенсомоторних порушеннях повинна бути адаптована до домашнього, соціального та професійного життя (SGB IX). На активність у цих сферах життя впливають не лише сенсомоторні навички, оскільки функції та структури тіла, діяльність та активність, фактори навколишнього середовища й індивідуальні фактори мають динамічний взаємозв’язок. Отже, реабілітація при сенсомоторних порушеннях повинна плануватись у загальному контексті реабілітації осіб з неврологічними розладами з метою сприяння відновленню сенсомоторних функцій і, отже, принаймні опосередковано, активності. В аналізі топ 10 пріоритетів досліджень з точки зору пацієнтів пошук стратегій підвищення впевненості у своїх силах після інсульту посідає 9-те місце (Pollock та співавт., 2014).
6.1. Мета
Цілі вважаються ключовим елементом реабілітації при сенсомоторних порушеннях, є мотивацією для пацієнтів і орієнтиром для лікарів — за умови, що вони сформульовані реалістично, зрозуміло, вимірювані й орієнтовані на поведінку. В ідеалі цілі формулюються разом з пацієнтами та будь-якими відповідальними особами, а також у міжпрофесійній команді. За основу слід взяти рівень активності МКФ (ВООЗ, 2005; Dekker та співавт., 2020; Leonardi та співавт., 2021). Такі методи, як канадська шкала продуктивності праці (COPM) (Phipps та Richardson, 2007), шкала досягнення індивідуальних цілей (GAS) (Turner-Stokes, 2009) та інструмент постановки цілей і планування дій (Scobbie та співавт., 2011; Scobbie та співавт., 2013), довели свою ефективність як стандартизовані методи встановлення цілей. Однак усе ще залишаються відкритими питання оптимального застосування цілей у реабілітації (Levack та співавт., 2015).
Ефективність різних методів лікування можна підвищити за допомогою структурованого зворотного зв’язку за умови цілеспрямованого застосування. Наприклад, щоденний зворотний зв’язок щодо швидкості ходьби під час лікування підвищує його ефективність (Dobkin та співавт., 2010). Існують також обнадійливі результати щодо застосування механізмів зворотного зв’язку на основі віртуальної реальності (Yang та співавт., 2008). Однак, особливо в технології віртуальній реальності та іграх, застосовуються різні візуалізації руху, що також можуть призводити до різних ефектів лікування (Ferreira dos Santos та співавт., 2016; Jin та співавт., 2022).
/14.jpg)
6.2. Методи лікування
Програми самоконтролю
Програми самоконтролю доведено покращують якість життя і впевненість людей у своїх силах після інсульту (Fryer та співавт., 2016). Програми спрямовані на підвищення впевненості у своїх силах і внутрішнього самоконтролю пацієнтів, щоб сприяти активності й запобігати довгостроковим наслідкам, таким як депресія (Nott та співавт., 2019). Призначаються вправи, які пацієнти можуть виконувати самостійно протягом дня (Singer та співавт., 2018).
Технологія віртуальної реальності також впливає на ігровий імпульс, а зворотний зв’язок від пристрою безпосередньо інтегрований у тренування.
Телереабілітація в рамках реабілітації при сенсомоторних порушеннях включає ще одну форму лікування з програмою самоконтролю. В огляді найпоширенішими платформами були теле- та відеоконференції. Простота застосування і прийнятність були оцінені високо, хоча проблеми з доступом і технічні проблеми можуть бути перешкодами для телереабілітації (Spits та співавт., 2022; Stephenson та співавт., 2022).
/14_2.jpg)
Залучення родичів
Родичі пацієнтів, які залишаються залежними від допомоги вдома після перебування в лікарні, повинні пройти кілька сеансів підтримки пацієнтів при зміні положення, ходьбі та іншій повсякденній діяльності. Це суттєво впливає на якість життя пацієнтів та їхніх родичів (Vloothuis та співавт., 2016).
У рамках роботи з родичами необхідно також передавати знання про специфічні симптоми захворювання, щоб родичі могли класифікувати ці симптоми і за необхідності звернутися до лікаря (De Silva, 2011; Cameron та співавт., 2014). Навчальні програми, що включають активну участь і дії (поєднання обговорень, презентацій, зустрічей і телефонних дзвінків), є більш ефективними, ніж виключно надання інформації (Crocker та співавт., 2021). Виконуючи роль учасників, опікунів і постачальників інформації, родичі роблять суттєвий внесок у процес лікування пацієнтів з неврологічними розладами і повинні бути включені до плану лікування (Payne та Grande, 2013; Winstein та співавт., 2016; Feichtner, 2020).
/15.jpg)
7. Реабілітація верхньої кінцівки
Thomas Platz, Bernhard Elsner
7.1. Наукове підґрунтя і докази
Існує багато методів лікування верхньої кінцівки із центральним парезом. Рекомендації повинні базуватися на систематичній доказовій базі в рамках підготовки керівництв Німецького товариства з нейрореабілітації (DGNR) (керівництво S3, Platz та співавт., 2020) і Міжнародної федерації нейрореабілітації (WFNR) (практичні рекомендації, засновані на доказах) щодо реабілітації верхніх кінцівок (Platz та співавт., 2021). Було систематично оцінено й використано 411 звітів про результати рандомізованих контрольованих досліджень і 114 систематичних оглядів (СО)/метааналізів. До літературних джерел було додано нещодавні систематичні огляди, пов’язані з дослідницьким питанням керівництва (пошук у базі даних PubMed, останні 5 років, станом на 27 серпня 2022 р.) щодо лікування інших порушень функції верхньої кінцівки (атаксія, акінетично-ригідний синдром, апраксія та соматосенсорні порушення), за пошуковим терміном «реабілітація» у комбінації з пошуковими термінами «атаксія», «паркінсонізм», «апраксія» або «соматосенсорний».
7.2. Діагностика і план лікування
Сенсомоторні порушення верхніх кінцівок можуть бути зумовлені центральним і периферичним парезом, а також атаксією, акінетично-ригідними руховими розладами, апраксією та розладами соматосенсорного сприйняття (поверхневої або глибокої чутливості). Усі зазначені синдроми є порушеннями функцій організму (ураження або порушення).
Їхній вплив на повсякденну діяльність, що виконується за допомогою верхніх кінцівок, називається активністю з обмеженою життєдіяльністю.
Здатності описують основні (органічно) можливі функції, а продуктивність — функції, що фактично застосовуються в повсякденній діяльності.
З огляду на вищезазначене ураження можуть бути причиною обмеження активності, причому різні види уражень обмежують діяльність і таким чином знижують працездатність.
З іншого боку, фактичне застосування функцій організму в повсякденній діяльності залежить не лише від здатностей, а й від ставлення та навченої поведінки, тому індивідуальна продуктивність не обов’язково повинна відповідати здатностям.
Результати неврологічного обстеження, підтверджені клінічно та, за необхідності, параклінічно, визначають наявні неврологічні розлади (ураження) як причини обмеження активності.
У контексті реабілітації ураження повинні бути більш детально визначені за допомогою стандартизованих оцінок.
Індивідуальна реабілітація при сенсомоторних порушеннях верхніх кінцівок включає також реєстрацію суб’єктивних та об’єктивних обмежень активності й працездатності.
На фоні цих етапів діагностики згодом можна визначити вплив уражень на активність. Порівняння здатностей і продуктивності та визначення факторів, що можуть спричинити розбіжності (наприклад, ставлення і навчена поведінка), також допомагають пояснити повсякденну діяльність. Усі ці етапи й міркування згодом ведуть до встановлення й узгодження цілей лікування з пацієнтами (можливо, диференційованими щодо функцій організму, активності й продуктивності), можливих втручань, що підтримують досягнення цілей, а також організаційних аспектів, таких як упровадження, інтенсивність, розподіл і тривалість лікування.
Для вибору відповідних інструментів оцінки див. відповідні огляди (наприклад, https://www.sralab.org/rehabilitation-measures).
/16.jpg)
7.3. Основні методи лікування
Центральний і периферичний парез, атаксія, акінетично-ригідні рухові розлади, апраксія або розлади соматосенсорного сприйняття, що впливають на поверхневу або глибоку чутливість, — усі вони належать до порушень нейронного контролю, опосередкованих різними мережами нервової системи.
У принципі відновлення, принаймні в основному та частково, можливе при всіх вищезазначених порушеннях функцій організму (неврологічних розладах), але, як правило, вимагає більш тривалого, спеціального й досить інтенсивного тренування. У тренуванні специфічно порушені функції конт-рольовано повторюються (ані недостатньо, ані надмірно) (Platz, 2004).
Відповідно до доказів із систематичних оглядів клінічних досліджень різних нижченаведених порушень покращання функції верхньої кінцівки можливе за допомогою спеціального тренування, якщо воно конкретно спрямоване на порушення функцій. З розподілом терапевтичних одиниць у вищезазначених дослідженнях (2–7 на тиждень тривалістю від 30 до 180 хвилин, від 4 до 12 тижнів) загальний час ефективного тренування (принаймні) 20 годин можна вважати орієнтиром для всіх порушень.
Відновлювальне лікування засновано на здатності ураженої нервової системи (часто частково) функціонально відновлюватись, реорганізовуватись і — також за допомогою тренування — змінювати й покращувати контроль за функціями організму (Platz та Lotze, 2018). Блоки керування функціями організму були змінені та вдосконалені (Platz та Lotze, 2018). Обґрунтуванням лікування порушень функції організму є те, що спеціальне й належне інтенсивне тренування функції організму може полегшити порушення функцій організму і таким чином опосередковано полегшити обмеження активності. Тому що порушення функцій організму є причиною обмеження активності.
Альтернативним підходом до лікування є самостійне тренування активності. Воно може бути ефективним, якщо порушення функції організму є не настільки серйозним, а активність усе ще можлива. Перевагою цього підходу є те, що можливе перенесення прогресу лікування в повсякденну діяльність є «автоматичним», але обмеженням є те, що тренування, орієнтоване на завдання, може менше полегшувати й відновлювати порушені функції організму.
Інший підхід до лікування включає сприяння продуктивності в рамках поточних здатностей, якщо існує розбіжність в тому, що здатності не застосовуються в повсякденній діяльності.
/16_2.jpg)
/17.jpg)
7.4. Специфічне лікування
Центральний парез верхньої кінцівки
Для ознайомлення з даними про реабілітацію центрального парезу верхньої кінцівки див. керівництво S3 «Реабілітація парезу верхньої кінцівки після інсульту», реєстраційний номер AWMF 080-001 (Platz та співавт., 2020). Інтегровано важливі рекомендації. Охарактеризовано методи лікування, що залежно від ступеня тяжкості парезу можуть застосовуватися як альтернативи або окремо в комбінації.
Рекомендації щодо лікування центрального парезу верхньої кінцівки
Час і тривалість лікування
/17_2.jpg)
/17_3.jpg)
Тренування, орієнтоване на ушкодження (ТОУ
(Пояснення. Тренування, орієнтоване на ушкодження, пропонує два методи лікування: тренування активності руки (ТАР) для пацієнтів з парезом верхньої кінцівки легкого ступеня тяжкості та систематичні повторні базові вправи для руки (БВР) для пацієнтів з парезом верхньої кінцівки тяжкого ступеня.)
/17_4.jpg)
Атаксія
Лікувальна фізкультура належної інтенсивності може полегшити симптоми мозочкової атаксії. Результати метааналізу 4 менших рандомізованих контрольованих досліджень вказують на те, що рухове тренування належної інтенсивності (в середньому 3 рази на тиждень по 60 хвилин протягом ≥ 4 тижнів) може полегшити тяжкість симптомів атаксії при мозочковій атаксії (загалом) порівняно з відсутністю лікування (шкала для оцінювання атаксії (SARA) (8 пунктів, 3 з яких стосуються функції руки); мін. 0, макс. 40 балів), зважена міжгрупова відмінність (МГВ): –3,3; 95% довірчий інтервал (ДІ) від –3,8 до –2,8; 4 РКД, 116 учасників) (Winser та співавт., 2022). Спеціальне порівняння різних концепцій лікування для сприяння функції верхньої кінцівки при мозочковій атаксії в рамках рандомізованих контрольованих досліджень (РКД) відсутнє.
/19.jpg)
Акінетично-ригідний синдром
Рухове тренування (3–7 разів на тиждень по 1/2–3 години протягом 4–8 тижнів; в одному дослідженні — до 14 місяців) покращило загальну рухову функцію в пацієнтів із хворобою Паркінсона порівняно з відсутністю тренувань (бал за Уніфікованою шкалою оцінки хвороби Паркінсона (UPDRS), середня відмінність (СВ): –6,09; 95% ДІ від –7,79 до –4,38; 5 досліджень, 179 учасників) (Choi та співавт., 2021).
Тривала фізіотерапія (≥ 1 разу на тиждень протягом ≥ 6 місяців) також покращувала рухову функцію пацієнтів із хворобою Паркінсона (загальна; у стані «вимкнено») (бал за Уніфікованою шкалою оцінки хвороби Паркінсона або UPDRS Міжнародної асоціації рухових розладів (MDS-UPDRS) (5 з 18 пунктів стосуються руки/кисті), стандартизована середня відмінність (ССВ): –0,65; 95% ДІ від –1,04 до –0,26; 5 досліджень, 408 учасників, Okada та співавт., 2021 р., див. також розділ 5 «Особливості рухових розладів»).
У систематичному огляді Foster та співавт. (2021) про вплив ерготерапії при хворобі Паркінсона в рамках РКД Collet та співавт. (2017) продемонстрували, що 6-місячне самостійне тренування під контролем терапевта для покращання почерку (рекомендація — 1 година спеціального тренування двічі на тиждень; 80 % пацієнтів тренувались принаймні 1 годину на тиждень) призвело до покращання навичок письма і підвищення самооцінки навичок письма через 1 рік порівняно з іншою практикою (UPDRS 2,7; відношення шансів (СШ): 0,55; 95% ДІ 0,34–0,91; 1 РКД, 105 учасників). Це демонструє, що спеціальне тренування активності з урахуванням специфічних для захворювання ефектів (ураження) також може бути ефективним з урахуванням тривалого тренування під наглядом.
Систематичний огляд впливу тренування, орієнтованого на завдання, на навички повсякденної діяльності з методологічно високоякісного РКД не підтвердив кількісно середній і клінічно значущий ефект через неоднорідність (розмір ефекту –0,53; 95% ДІ від –1,08 до 0,02; p = 0,06; неоднорідність I2 88 %; 5 досліджень, 485 учасників) (Perry та співавт., 2019). Метарегресійний аналіз продемонстрував, що ефекти лікування можна було виявити лише при принаймні 1 годині тренувань на тиждень і вони підвищувались при тренуванні до 7 годин на тиждень.
/19_2.jpg)
Апраксія
Як ідеомоторна апраксія (порушення репрезентації інваріантних властивостей моторних рухів), так і ідеаційна апраксія (втрата вміння використовувати предмети) погіршують повсякденну діяльність (Platz, 2005).
Систематичний огляд демонструє, що як інтенсивне компенсаторне стратегічне тренування (2 РКД, 143 пацієнти з інсультом та апраксією), так і відновлювальне тренування жестів (2 РКД, 46 пацієнтів з інсультом та апраксією) можуть полегшити функціональні порушення, пов’язані з апраксією, а також навички повсякденної діяльності (Alashram та співавт., 2021). У рамках перевіреного тренування серії перехідних (пов’язаних з об’єктами) жестів, а також незначних неперехідних жестів із зростаючою складністю виконувались 50-хвилинні вправи 3 рази на тиждень протягом 10–12 тижнів. Під час стратегічного тренування, що включало загалом 25 30–40-хвилинних вправ протягом 8–12 тижнів, пацієнти вчаться компенсувати порушення, пов’язані з апраксією, розділяючи повсякденні завдання на фази підготовки, виконання і контролю, і вчаться справлятися з будь-якими перешкодами, застосовуючи альтернативні стратегії.
/19_3.jpg)
Порушення соматочутливості
Систематичний огляд на основі серії випадків (5 досліджень) і контрольованих досліджень (5 досліджень) (≥ 10 учасників на дослідження; n = 199 пацієнтів після інсульту), у якому вивчався вплив тренування дискримінації соматосенсорної системи на сенсорні функції верхніх кінцівок (рук і кистей) у пацієнтів після інсульту, виявив розміри ефекту 0,3–2,2 (середнє значення 0,85) для показників поверхневої та глибинної чутливості, а також тактильне сприйняття об’єктів (Turville та співавт., 2019). Результати досягались за допомогою 70-хвилинних тренувань 2–3 дні на тиждень протягом 4–8 тижнів, частково за допомогою самостійного тренування (15–90 хвилин на добу).
Соматосенсорне тренування також може позитивно впливати на рухові функції верхніх кінцівок (порівняно з плацебо) (СВ; шкала Фугл-Мейєра 2,75; 95% ДІ 1,53–3,96; 6 РКД, 179 учасників; тест рухової активності верхньої кінцівки 2,80; 95% ДІ 2,27–3,32; 6 РКД, 141 учасник) (Sarrada та співавт., 2019).
В іншому систематичному огляді вплив на (поверхневе) соматосенсорне сприйняття частіше спостерігався при пасивному сенсорному тренуванні (ССВ 1,13; 95% ДІ 0,20–2,05; 2 РКД, 47 учасників) і на рухові функції — при активному сенсорному тренуванні (ССВ 0,73; 95% ДІ 0,14–1,32; 2 РКД, 48 учасників) (Yilmazer та співавт., 2019).
/20.jpg)
8. Реабілітація для відновлення стояння та ходьби
Christian Dohle, Gabriele Eckhardt, Klaus Jahn, Simon Steib
8.1. Наукове підґрунтя і докази
Неврологічні захворювання вимагають індивідуального підходу для відновлення і покращання здатності до ходьби, переважно на основі об’єктивної оцінки порушень (наприклад, аналіз ходьби) (Schelhaas та співавт., 2022). Терапевтичні втручання включають, зокрема: повторюване тренування рухових послідовностей/етапів, повсякденне тренування (ТСД), акватренінг, біологічний зворотний зв’язок, дзеркальну терапію, ортозування, когнітивно-поведінкову терапію, тренування уявних образів, тренування на витривалість і силу, тренування з використанням пристроїв (Motomed, ергометр, робототехніка). Крім того, існує нейромодуляція (наприклад, транскраніальна магнітна стимуляція (ТМС), мікрополяризація) та функціональна електрична стимуляція (ФЕС).
Для реабілітації рухливості після інсульту, поширеного захворювання центральної нервової системи, у 2015 році було опубліковано керівництво S2e на основі систематичного огляду літературних джерел Німецького товариства з нейрореабілітації (DGNR) і Physio Deutschland (Німецька асоціація фізіотерапевтів) (робоча група ReMoS та співавт., 2015; Dohle та співавт., 2016), що було частково оновлено (Goetz та співавт., 2021). У 2022 році це дослідження було продовжено й оновлено групою з розробки керівництв. Рекомендації цього керівництва було описано на основі 5 цілей лікування: відновлення здатності до ходьби, покращання здатності до ходьби, збільшення швидкості ходьби та дистанції безбольової ходьби і покращання рівноваги. Існує окреме керівництво щодо лікування спастичності після інсульту (Platz та співавт., 2018). При розсіяному склерозі також використовували керівництво DGNR щодо покращання рухливості в цій групі пацієнтів (Tholen та співавт., 2019).
/20_2.jpg)
8.2. Відновлення ходьби в неамбулаторних пацієнтів
Основними заходами для відновлення здатності до ходьби після ураження центральних рухових нейронів є спочатку досягнення вертикалізації, а потім виконання якомога більшої кількості ходових рухів (кроків). Через велику опору для тих, хто не може ходити, необхідно використовувати обладнання по змозі. У рамках робототерапії, що доцільно застосовувати для виконання великої кількості кроків, розрізняють два принципи терапії: принцип кінцевого ефекту з виключним керуванням стопами та принцип екзоскелета з додатковим моторизованим контролем та управлінням колінними й тазостегновими суглобами. У принципі успіх лікування аналогічний суто індивідуальному тренуванню з порівнянною кількістю повторень (Peurala та співавт., 2009; Nascimento та співавт., 2021). Також подані докази того, що висока технічна складність принципу екзоскелета не перевершує простіші налаштування робочого органа (Mehrholz та співавт., 2020).
Якщо здатність до ходьби (також) обмежена тяжкою спастичністю, можна застосовувати інші підходи, такі як фізіотерапія (ФТ) та антиспастичні препарати, такі як баклофен (для перорального або інтратекального введення) і ботулотоксин; тут робиться посилання на конкретне керівництво. Найкращі докази щодо лікування спастичності при РС спостерігалися при самостійній лікувальній фізкультурі й амбулаторних програмах вправ на м’язовий тонус або спастичність (Etoom та співавт., 2018).
/21.jpg)
8.3. Покращання здатності до ходьби в амбулаторних пацієнтів (з обмеженими можливостями)
Навіть у пацієнтів, які можуть ходити хоча б за допомогою допоміжних засобів, необхідно часто повторювати рухи ходьби, щоб покращити здатність до ходьби. Крім того, необхідно відпрацьовувати складніші вправи, щоб активувати непрацюючі центральні мережі (Jahn та співавт., 2010; Jahn та співавт., 2020). На відміну від пацієнтів, які не можуть ходити, підтримуюче обладнання (бігова доріжка з підтримкою ваги та без неї) є необов’язковим. Поточні метааналізи не демонструють переваги тренувань на біговій доріжці порівняно зі звичайними програмами тренувань ходьби в підгострій фазі (Hsu та співавт., 2020; Nascimento та співавт., 2021). Навіть нещодавно розроблені мобільні механічні пристрої з опорою або мобільні екзоскелети ще не довели своєї переваги (Bizocivar та співавт., 2017 р., Rojek та співавт., 2020). Тренування може супроводжуватися зворотним зв’язком при ходьбі (словесним або візуальним; Hunt та співавт., 2018; Hunt та Takacs, 2014). Тренування зі зворотним зв’язком є ефективнішим, ніж зовнішні пристрої, для тривалого покращання якості кроку. Існують різні допоміжні засоби для покращання неправильного положення або нестійкості (устілки, гомілковостопні ортези, примірка взуття, ремені для зовнішньої ротації), але їхня дія обмежена тривалістю належного застосування (Ganjehie та співавт., 2017). У пацієнтів зі спастичною еквіноварусною деформацією місцева ін’єкція ботулотоксину знижує необхідність у допоміжних пристроях, але несуттєво покращує швидкість ходьби (Pittock та співавт., 2003).
/21_2.jpg)
8.4. Збільшення швидкості ходьби
Якщо необхідно збільшити швидкість ходьби в амбулаторних пацієнтів, основним принципом лікування є не збільшення кількості повторень, а безперервне збільшення швидкості ходьби, що найкраще досягається за допомогою тренувань на біговій доріжці (Pohl та співавт., 2002). Існують вагомі докази щодо ефективності кардіореспіраторного тренування для збільшення швидкості ходьби після інсульту і досягнення іншого позитивного впливу на здоров’я (включно з кардіореспіраторним фітнесом, рухливістю, інвалідністю; Saunders та співавт., 2020). Неспецифічне тренування на витривалість (наприклад, на велоергометрі) є менш ефективним або неефективним у збільшенні швидкості ходьби. Комбінація із силовими тренуваннями може бути раціональним розширенням (Lee та Stone, 2020; Saunders та співавт., 2020) і має бути заснована на рекомендаціях Американської асоціації інсульту (Pogrebnoy та Dennett, 2020). Додавання вправ для стабілізації тулуба до стандартної фізіотерапії після інсульту також покращить швидкість ходьби (Gamble та співавт., 2021). Акватренінг є ще одним ефективним методом лікування, що можна застосовувати як додаткову терапію (Saquetto та співавт., 2019; Veldema та Jansen, 2021).
При розсіяному склерозі кардіореспіраторні тренування необхідно застосовувати для збільшення швидкості ходьби (Tholen та співавт., 2019; Andreu-Caravaca та співавт., 2021), а силові тренування є так само ефективними для покращання функції ходьби (Taul-Madsen та співавт., 2021). При хворобі Паркінсона силові тренування доказово збільшують швидкість ходьби, але на сьогодні немає переваги над іншими тренуваннями (Gollan та співавт., 2022).
/21_3.jpg)
8.5. Збільшення дистанції безбольової ходьби
Якщо пацієнти вже можуть впевнено ходити, а відстань потрібно збільшити, тренування ходьби має враховувати особливості серцево-судинної системи (Saunders та співавт., 2020; Gordon та співавт., 2004; Pogrebnoy та Dennett, 2020). Окреме тренування на витривалість без функціональних рухів, наприклад на велоергометрі, не збільшує дистанцію ходьби (Katz-Leurer та співавт., 2003). За необхідності можна розглянути силові тренування або комбіновані програми вправ на силу і витривалість; однак сила доказів у пацієнтів після інсульту все ще є низькою (Saunders та співавт., 2020). Кардіореспіраторне тренування також необхідно застосовувати для збільшення дистанції ходьби при розсіяному склерозі (Tholen та співавт., 2019; Taul-Madsen та співавт., 2021) і хворобі Паркінсона (Gamborg та співавт., 2022; Schootemeijer та співавт., 2020).
/22.jpg)
8.6. Покращання рівноваги при стоянні та ходьбі
Цільові програми тренувань із вправами на рівновагу і/або зміну ваги, а також з інтенсивним тренуванням ходьби позитивно впливають на рівновагу пацієнтів після інсульту (van Duijnhoven та співавт., 2016). У пацієнтів з розсіяним склерозом (розділ 4.1.3; Gunn та співавт., 2015; Selph та співавт., 2021) і ранньою стадією хвороби Паркінсона тренування на рівновагу також є ефективним (Shen та співавт., 2016; Zhong та співавт., 2020). Воно є ефективним і при сенсорних розладах (вестибулярних, пропріоцептивних). Існують дуже вагомі докази покращання рівноваги за допомогою специфічного тренування (Meldrum та співавт., 2020; Hall та співавт., 2022). Акватренінг можна запропонувати як доповнення (Nascimento та співавт., 2020; Shariat та співавт., 2022; Caroll та співавт., 2020; Veldema та Jansen, 2021). Крім того, цільове тренування корпуса може покращити рівновагу під час сидіння і стояння (Van Criekinge та співавт., 2019).
/22_2.jpg)
8.7. Важливість мотивації у фізичній реабілітації
Пацієнти після інсульту часто неактивні та проводять тривалий час у сидячому положенні. Це погіршує серцеві й метаболічні параметри та впливає на фізичні та інші функції. Втручання, спрямовані на скорочення або припинення сидячого способу життя і збільшення фізичної активності після інсульту, можуть знизити ризик вторинних серцево-судинних явищ і смерті через певний час після інсульту (Saunders та співавт., 2021).
Мотивація дозволяє підвищити ефективність обох методів лікування за допомогою пристроїв і стандартних методів лікування. Наприклад, щоденний зворотний зв’язок щодо швидкості ходьби під час лікування підвищує його ефективність (Dobkin та співавт., 2010). Існують також обнадійливі результати щодо застосування механізмів зворотного зв’язку на основі віртуальної реальності (Laver та співавт., 2017). Однак, особливо при технології віртуальної реальності, застосовуються різні візуалізації руху, що також мають різні ефекти лікування (Ferreira dos Santos та співавт., 2016; de Keersmaeker та співавт., 2019). Для цього необхідні подальші спеціальні дослідження.
Хоча на сьогодні існують вагомі докази на користь багатьох із зазначених тверджень, послідовне впровадження отриманих рекомендацій все ще є недостатнім (Scheffler та співавт., 2022). Тому в майбутні керівництва також необхідно включати концепції послідовного впровадження та концепції забезпечення якості.
/22_3.jpg)
9. Фізична реабілітація при втомі
Christian Dettmers
Розрізняють втому і втомлюваність (Kluger, Krupp та Enoka, 2013). Втома є суб’єктивним відчуттям пацієнта. Її довгостроковий компонент часто реєструють за допомогою опитувальника. Короткочасне виснаження реєструють за допомогою візуальної аналогової шкали.
Втома є вираженою та виміряною зміною продуктивності в момент виснаження, наприклад, виражені зміни ходьби (Behrens, 2021). Найвдалішим моментом для відеореєстрації є момент виснаження під час обстеження на біговій доріжці. Існують різні способи оцінки й кількісного визначення втоми (Broscheid, 2021).
На сьогодні відсутні дослідження втомлюваності як параметри результатів.
Під час анкетування пацієнтів реєстрували суб’єктивні симптоми захворювання. У німецькомовних країнах, як правило, використовують Вюрцбурзьку шкалу впливу втоми на РС (WEIMuS), шкалу втомлюваності для моторики й оцінки когнітивних функцій (FSMC), шкалу оцінки тяжкості втоми (FSS) та модифіковану шкалу впливу втоми (MFIS) (див. Sander, Voelter, Schlake, Eling та Hildebrandt, 2017). Слід зазначити, що ці шкали оцінки втоми не корелюють із соціально-медичною оцінкою ефективності або не є клінічно значущими (Dettmers, Joebges, Schmidt, 2020; Dettmers, Marchione, Weimer-Jaekel, Godde та Joebges, 2021). Встановлено відмінність між моторною та когнітивною втомою. Крім того, до них додається емоційна або психосоціальна втома (Linnhoff, Fiene, Heinze та Zaehle, 2019; Stoll, 2021).
Патофізіологія моторної втомлюваності не зрозуміла. Це може бути оборотний блок проведення через надмірне навантаження («блок проведення, що залежить від застосування» (Vucic, Burke та Kiernan, 2010)). Пацієнти повинні знати, що це явище завжди є оборотним і що навантаження не може порушити нервову систему, навіть якщо це призводить до тимчасового порушення функції. В іншому випадку ця хронічна втома призводить до бездіяльності та «вимушеного» положення пацієнта. Моторна втомлюваність може бути подібною до погіршення функції через жар/лихоманку (феномен Утгофа). Тому тренування є важливим етапом у лікуванні моторної втоми.
Втома суттєво впливає на працездатність і якість життя пацієнтів з розсіяним склерозом (Kobelt та співавт., 2017). Отже, полегшення втоми повинно бути основним питанням реабілітації. Розглядаючи можливості рухової реабілітації при втомі, необхідно враховувати, що втома є багатовимірною структурою (див. вище) і що на когнітивному та емоційному рівнях можуть розглядатися більш інтенсивні методи лікування, ніж у руховій сфері, або однакові. Learmonth та Motl наголошують на важливості тренування в пацієнтів із РС і вказують на важливу роль неврологів і фахівців у сфері охорони здоров’я в коригуванні поведінки пацієнтів (Learmonth та Motl, 2021).
Враховуючи вплив рухового тренування на втому, необхідно розрізняти вплив на моторну, когнітивну та емоційну втому. Цього не було чітко відокремлено. Крім того, необхідно відзначити, що в більшості досліджень моторна втома ще не вивчалася як параметр результату.
Найважливіші втручання для полегшення втоми належать або до категорії тренувань на витривалість, силу, рівновагу або змішану фізичну підготовку, або, з іншого боку, до категорії когнітивно-поведінкової терапії або підходу, заснованого на уважності. У кокранівському огляді 2015 року (Heine, van de Port, Rietberg, van Wegen та Kwakkel, 2015) виявилось суттєве зменшення суб’єктивної втоми завдяки лікувальній фізкультурі (ССВ) –0,53, 95% ДІ від –0,73 до –0,33; p < 0,01). Ефекти спостерігались у групі тренувань на витривалість (ССВ фіксований ефект –0,43, 95% ДІ від –0,69 до –0,17; p < 0,01), змішаних втручань (ССВ випадковий ефект –0,73, 95% ДІ від –1,23 до –0,23; p < 0,01) та інших типів тренувань (ССВ фіксований ефект –0,54, 95% ДІ від –0,79 до –0,29; p < 0,01). Систематичний огляд підтверджує, що фізичні вправи полегшують втому (Razazian та співавт., 2020). Данська робоча група, що протягом тривалого часу вивчає вплив фізичних вправ на РС, у метааналізі повідомляє, що тренування на витривалість і силу є однаково високоефективними для полегшення суб’єктивної втоми та продуктивності (Taul-Madsen та співавт., 2021). Величина ефекту тренування на витривалість для коротких дистанцій становить 0,33, для довгих дистанцій — 0,37, а для суб’єктивної втоми — –0,61. Відповідні величини ефекту для силового тренування становлять 0,27; 0,36 і –0,41. Для цього враховувались результати 22 РКД за участю 966 пацієнтів. Бал за шкалою EDSS для включених пацієнтів коливався від 1,5 до 7, а тривалість захворювання — від 2,7 до 18,6 років.
Якщо порівняти величину ефекту фізичного тренування й розумового втручання, одне дослідження продемонструвало, що тренування на рівновагу найбільше впливає на втому, за яким йдуть когнітивно-поведінкова терапія, терапія з руховими вправами, силові тренування, комбіновані тренування, тренування на витривалість, техніки релаксації, когнітивно-поведінкова терапія разом з лікувальною фізкультурою тощо (Harrison та співавт., 2021). Серед них когнітивно-поведінкова терапія має найсильніший ефект через 3–6 місяців за умови, що її метою є лікування втоми, а не депресії або стресу (Harrison та співавт., 2021).
У керівництвах NICE також рекомендується комбінація тренувань на витривалість, силових тренувань, тренувань на рівновагу і когнітивно-поведінкової терапії для лікування втоми (Excellence, 22 червня 2022). «Енергозберігаюча терапія», що була розроблена для лікування РС, майже не дає ефекту (Harrison та співавт., 2021). Окремі програми тренування також не є ефективними. Комбінація лікувальної фізкультури та когнітивно-поведінкової терапії є ефективною (Harrison та співавт., 2021). Як завжди в реабілітації, основою плану тренувань має бути аналіз конкретних причин втоми та врахування уподобань пацієнтів. Це результат бездіяльності? Порушення рівноваги забирає забагато уваги, концентрації та енергії? Чи є страх порушення функцій через навантаження/перевантаження? Чи можна уникнути навантажень? Чи є інші фактори стресу?
/23.jpg)
10. Медикаментозне лікування в рамках фізичної реабілітації
Joachim Liepert
10.1. Додаткова інформація
-У перші тижні після інсульту спостерігається фаза посиленої нейропластичності, що триває кілька тижнів, під час якої відбувається максимальне збільшення діапазону рухів. Мета підтримуючого медикаментозного лікування — подовжити цю фазу та/або посилити нейропластичні процеси протягом цієї фази (Joy та Carmichael, 2021). Основним принципом моторного навчання є тривале потенціювання (ТП) (Kruijssen та Wierenga, 2019). ТП на певний час (> 30 хв) посилює синаптичну передачу за рахунок збільшення синаптичного зв’язку. Багато відомих систем церебральних передавачів можуть впливати на ТП. Особливо це помітно в експериментах на тваринах. Досі було проведено багато фармакологічних досліджень пацієнтів після інсульту, у яких, зокрема, стимулювались нейромедіатори дофамін і серотонін. Для оцінки ефективності медикаментозного лікування враховують або ступінь інвалідності, виміряний за модифікованою шкалою Ренкіна (mRS) (Banks та Marotta, 2007), або оцінку рухових функцій, виміряну, наприклад, за шкалою Фугл-Мейєра (FMA) (Berglund та Fugl-Meyer, 1986).
Інгібітори зворотного захоплення серотоніну
Більше даних доступно для флуоксетину. У 3 великих плацебо-контрольованих дослідженнях (FOCUS, AFFINITY, EFFECTS) за участю 5907 пацієнтів вивчали вплив флуоксетину на ступінь інвалідності (Співпраця в рамках дослідження AFFINITY, 2020; Співпраця в рамках дослідження EFFECTS, 2020; Співпраця в рамках дослідження FOCUS, 2019). Ці дослідження продемонстрували відсутність впливу. У групі флуоксетину було зафіксовано менше випадків депресії, але більше випадків падінь, переломів, епілептичних нападів і гіпонатріємії. Отже, флуоксетин не впливає на ступінь інвалідності, але відповідно до метааналізу 9 контрольованих досліджень, включно з даними 6788 пацієнтів, він може покращити рухові функції, виміряні за шкалою Фугл-Мейєра (Liu та співавт., 2021).
Циталопрам зміг покращити рухові функції в кількох дослідженнях з малими розмірами вибірки, але результати були суперечливими в дослідженнях з більшими вибірками. У дослідженні за участю 108 учасників у групі циталопраму було більше учасників, чий бал за шкалою інсульту Національного інституту охорони здоров’я покращився на > 50 %, ніж у групі плацебо (Savadi Oskouie та співавт., 2017). Більше дослідження за участю 642 пацієнтів не виявило суттєвої відмінності в групах циталопраму і плацебо з точки зору покращання функцій (Kraglund та співавт., 2018).
/24.jpg)
L-допи
Доза 100 мг L-дигідроксифенілаланіну на добу (протягом 3 тижнів) покращила функції верхньої кінцівки не більше, ніж плацебо (n = 53 пацієнти з підгострим інсультом) (Scheidtmann та співавт., 2001). Однак у більшому дослідженні за участю 593 пацієнтів після інсульту не спостерігалось відмінностей у групах L-дигідроксифенілаланіну (100 мг до лікування) і плацебо щодо здатності до самостійної ходьби, функції верхньої кінцівки, бала за шкалою інвалідності (mRS), повсякденної діяльності (індекс Бартел) і когнітивних здібностей (Монреальська когнітивна шкала) (Ford та співавт., 2019). Отже, L-дигідроксифенілаланін не можна рекомендувати для відновлення рухової функції.
/24_2.jpg)
Амфетамін
Амфетаміни, як непрямі стимулятори вивільнення дофаміну і норадреналіну, також були вивчені на предмет функціонального ефекту. У 3 невеликих дослідженнях за участю 34 пацієнтів амфетамін був більш ефективним, ніж плацебо, але в 7 інших дослідженнях за участю 291 пацієнта амфетамін був не більш ефективним. Отже, на сьогодні недостатньо доказів ефективності цієї речовини (Liepert, 2021).
Церебролізин®
Церебролізин® — це суміш ферментативно оброблених пептидів, отриманих з мозку свині, що має нейропротекторні та нейротрофічні властивості в експериментах на тваринах. Плацебо-контрольоване дослідження, у якому Церебролізин® або плацебо вводили протягом 21 дня (n = 205 пацієнтів), продемонструвало перевагу лікарського засобу в тесті функції верхньої кінцівки (Muresanu та співавт., 2016). Метааналіз 9 контрольованих досліджень виявив, що Церебролізин® був пов’язаний з нижчим балом за шкалою інсульту Національного інституту охорони здоров’я (= незначний неврологічний розлад) і нижчим балом за шкалою інвалідності (mRS) (Bornstein та співавт., 2018). Інше нещодавнє дослідження за участю 110 пацієнтів після інсульту (Chang та співавт., 2021) продемонструвало, що Церебролізин® плюс реабілітація покращили рухові функції, особливо в пацієнтів після тяжкого ураження. Церебролізин® необхідно вводити у вигляді короткочасної інфузії, він схвалений в Австрії.
/25.jpg)
Дальфампридин
У плацебо-контрольованому дослідженні за участю 70 пацієнтів після інсульту дальфампридин покращував швидкість ходьби більше, ніж плацебо (Simpson та співавт., 2015).
Однак нещодавнє дослідження за участю 377 пацієнтів після підгострого інсульту не виявило відмінності в здатності ходити в групах дальфампридину та плацебо (Page та співавт., 2020).
Інші речовини
Нейроейд® включає 9 трав і 5 екстрактів тваринного походження, є частиною традиційної китайської медицини і не схвалений у Німеччині. Застосування знижувало ступінь втрати працездатності в пацієнтів після тяжкого інсульту (бал за шкалою Національного інституту охорони здоров’я 10–14) (Suwanwela та співавт., 2018).
CEGI є сумішшю м’язової тканини кролика і гангліозидів з головного мозку великої рогатої худоби, вона призначена для внутрішньовенного введення і не схвалена у Німеччині. У пацієнтів після інсульту з балом за шкалою Національного інституту охорони здоров’я 8–16 застосування суттєво покращило бал за шкалою інвалідності (mRS), індекс Бартел і бал за шкалою Національного інституту охорони здоров’я (Zhang та співавт., 2020).
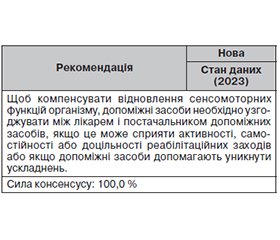
11. Надання допоміжних засобів у рамках реабілітації при сенсомоторних порушеннях
Thomas Platz, Anna Engel
Для багатьох пацієнтів із сенсомоторними порушеннями неврологічне реабілітаційне лікування часто покращує повсякденну діяльність, але не відновлює сенсомоторні функції повністю. Тривалий сенсомоторний розлад можна компенсувати за допомогою лікування.
Якщо стаціонарна реабілітація здійснюється після надання невідкладної допомоги, реабілітаційний заклад надає допоміжні пристрої. Потім реабілітаційна команда під наглядом підбирає цілеспрямовану й адресну допомогу разом з фахівцями відповідного медичного закладу. За відсутності подальшої реабілітації, наприклад, якщо пацієнтів спочатку виписують або вони проходять амбулаторну реабілітацію, допоміжні засоби вже надаються у відділенні невідкладної допомоги.
Допомога, що надається на момент виписки, додатково модифікується амбулаторно постачальниками амбулаторних послуг разом з постачальниками допомоги відповідно до подальшого розвитку клінічної картини та прогресу реабілітації.
Розрізняють такі засоби пересування, як палиці, ролятори й крісла колісні, засоби для санітарної зони, такі як ручки для туалету і ванної кімнати, підвищене сидіння унітазу, засоби для входу в душ або ванну, підйомники для ванни й житлової зони, поручні, функціональне ліжко і мобільний підйомник для пацієнтів.
До допоміжних засобів також відносяться ортопедичні вироби, такі як ортези та протези. Вони можуть застосовуватися як для компенсації, так і для відновлювального лікування.
Надання допомоги орієнтоване на сприяння активності (див. розділ 6 «Реабілітація для сприяння активності») відповідно до індивідуальних потреб, що впливають як на функції організму, так і на соціальний і побутовий контекст. Наприклад, адаптація крісла колісного до потреб у повсякденній діяльності вимагає призначення, при якому враховуються розміри тіла, а також моторика (може знадобитися додатковий електропривод) і потреби в повсякденній діяльності (наприклад, спеціальна подушка для сидіння, столик для крісла колісного, підставка для ніг, відкидні бічні стійки).
Для планування допоміжних засобів для житлових і санітарних зон необхідно спочатку відвідати ці приміщення.
/25.jpg)

/18.jpg)