Журнал «Внутренняя медицина» 5-6(11-12) 2008
Вернуться к номеру
Нейтрофилы и моноциты при повреждении сосудистого эндотелия как звенья единой патогенетической цепи в развитии хронической болезни почек и атеросклероза
Авторы: И.И. Топчий, д.м.н., профессор, заведующий отделом нефрологии ГУ «Институт терапии им. Л.Т. Малой АМН Украины», г. Харьков
Рубрики: Семейная медицина/Терапия, Терапия
Версия для печати
На основе анализа данных обследования 517 больных с хронической болезнью почек (171 пациент с хроническим гломерулонефритом, 179 — с диабетической нефропатией и 167 пациентов с гипертонической болезнью (группа сравнения)), находившихся на лечении в Институте терапии, а также данных литературы рассмотрены механизмы поражения сосудов у пациентов с заболеваниями почек. Анализ результатов выполненных исследований показал этапность воспалительного отслоения клеток эндотелия под воздействием оксидантного стресса, клеток белой крови (нейтрофилов и моноцитов) с последующим ухудшением NO-образующей функции эндотелия. Рассматриваются вопросы фармакологической коррекции выявленных нарушений с улучшением VE-кадгериновых межклеточных связей, замещения клеток эндотелия, перенесших апоптоз.
хроническая болезнь почек, ICAM, VCAM, атеросклероз, нейтрофилы, моноциты, VE-кадгерин, аноикис, CD146, CD34, NO-синтазы.
В клинике внутренних болезней в настоящее время используется такой показатель поражения сердечно-сосудистой системы, как наличие микроальбуминурии. Кардиологам не от хорошей жизни приходится вводить в обиход чисто нефрологический термин — слишком мало количественных методов определения поражения сосудов на ранних стадиях заболевания. Наши почки фильтруют весь объем крови около 30 раз в день, повторно абсорбируя > 95 % фильтрата, для того чтобы произвести всего 1–2 литра мочи. Почки также регулируют множество других функций организма, а их архитектоника такова, что все уникальные пространственные связи сосудов этого органа подвергаются большим нагрузкам и испытаниям, чем другие органы человека. Безусловно, при хронической болезни почек (ХБП) помимо традиционных имеется множество дополнительных факторов риска атеросклероза, включающих альбуминурию, дисбаланс электролитов, воспаление, увеличенный окислительный стресс и нарушения в системе L-аргинин/оксид азота (NO) [7, 11, 22]. Пациенты с ХБП чаще умирают от ишемической болезни сердца (ИБС), чем в общей популяции. Kidney Disease Outcomes Quality Initiative (2003) признает, что ХБП является фактором риска ИБС [31]. Вместе с тем в последнее время особое внимание исследователей стало привлекать состояние сосудистого эндотелия, клетки которого, будучи монослоем, занимают огромную площадь. Было установлено, что выполнять свои многочисленные функции эти клетки могут только при условии целостности эндотелиального слоя [5, 36].
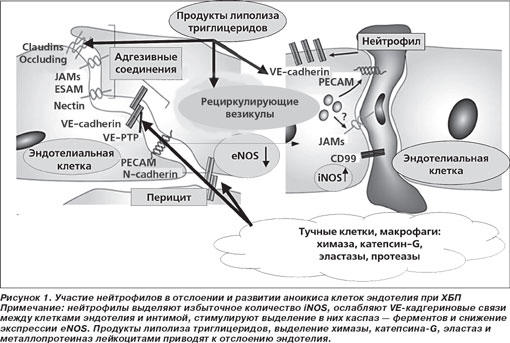
Пронализировав результаты обследования 517 больных в возрасте 35–65 лет (240 мужчин и 277 женщин), находившихся на лечении в Институте терапии, из которых у 171 больных был диагностирован хронический гломерулонефрит (ХГН), у 179 больных — диабетическая нефропатия (ДН), у 167 больных — гипертоническая болезнь (ГБ, группа сравнения), а также учитывая работы M. Mayranpaa et al. (2006), мы высказали предположение о возможном участии нейтрофилов и ICAM в отслоении клеток эндотелия, приводящего к появлению эрозий как в капиллярах клубочков, так и в магистральных сосудах [5, 10, 33] (рис. 1).
Больные были разделены на 3 основные группы: I группа — 131 пациент с микроальбуминурией, II группа — 74 больных с протеинурией и III группа — 312 больных без наличия белка в моче. Все группы были сопоставимы по возрасту и полу. В исследование не включали больных с повышенным уровнем креатинина в плазме крови, наличием нестабильной стенокардии, системными заболеваниями соединительной ткани и лиц, переживших острые сосудистые катастрофы менее 1 года назад. При этом среди больных с нормоальбуминурией лица с наличием стабильной стенокардии, клинических и инструментальных данных о поражениях периферических и церебральных сосудов, перенесенном инфаркте миокарда или ишемическом инсульте составили 18 %, среди больных с микроальбуминурией — 37 %, с протеинурией — 41 %.
С учетом работы K. Daub et al. (2006) была высказана гипотеза о том, что тромбоциты, которые в норме рекрутируют эндотелиальные клетки-предшественники (ЭКП) CD-34 в зону отслоения и апоптоза эндотелия для его замещения, при их активации под воздействием оксидантного стресса вызывают трансформацию этих клеток в пенистые [23]. Связь этих показателей с выраженностью альбуминурии может свидетельствовать о нарушении процессов репарации эндотелия капилляров клубочков с сохраняющимися на неопределенное время участками десквамации в местах предполагаемого отслоения CD146 клеток-aноикис (греч. «бездомный») — клеток эндотелия, подвергшихся апоптозу и какое-то время циркулирующих в крови (рис. 2).

Вместе с тем эндотелиальные клетки являются одной из главных клеточных составляющих кровеносных сосудов, и одно из наиболее важных их свойств — функция привратника, контролирующего инфильтрацию белков и клеток крови в стенку сосудов [30]. Эти уникальные характеристики достигаются благодаря специализированной трансцеллюлярной системе везикулярного транспорта и скоординированному открытию и закрытию межклеточных соединений (МКС). Установлено, что межклеточные соединения являются не только местами прикреплений между эндотелиальными клетками — они могут функционировать как сигнальные структуры, сообщающие клетке о ее положении, границах роста, апоптозе, и регулировать сосудистый гомеостаз в целом [25].
МКС образуются с помощью трансмембранных адгезивных белков, таких как VE-cadherin в AJs и claudin-5 в TJs [19], которые обеспечивают связь между клетками в виде застежек-молний по краям клеток. Внутри клеток адгезивные белки МКС сцеплены с актиновым цитоскелетом, и это взаимодействие стабилизирует монослой эндотелиальных клеток. Благодаря своим цитоплазматическим хвостам адгезивные белки МКС связаны с цитоскелетом и сигнальными белками, что делает возможным закрепление адгезивных белков на актиновых микрофиламентах и перенос сигналов внутрь клетки [26]. Недавние исследования показали, что эти структуры играют центральную роль в стабилизации эндотелия в покоящемся состоянии — переключение этих клеток со сливного, покоящегося состояния в состояние миграции и пролиферации, например во время образования новых сосудов, сопровождается модуляцией организации и системы передачи сигналов МКС [24]. Специализированная трансцеллюлярная система пузырьков включает органеллы эндотелиальных клеток, известные как vesiculo-vacuolar органеллы — рециркулирующие везикулы (РВ), которые участвуют в трансэндотелиальном прохождении растворимых макромолекул. Эти системы поддерживают интегральность эндотелия и защищают сосуды от любого неконтролируемого увеличения проницаемости, воспаления или тромботических реакций. Изменение баланса NOS в плазме крови у обследованных нами больных может свидетельствовать о нарушении NO-образующей функции эндотелия у больных ХБП в связи с уменьшением содержания eNOS; при этом уменьшение NO-опосредованных противосвертывающих свойств может вносить вклад в прилипание и агрегацию клеток крови в пределах поврежденного эндотелия [12]. Ранее мы показали, что у больных ХБП в связи с оксидантным стрессом нарушается выделение NO из его депо в S-нитрозотиолах [16]. В последнее время появились данные, свидетельствующие о том, что еще одним источником депонированного NO является нитрит, поэтому выявленное нами снижение содержания нитрита при альбуминурии может также свидетельствовать о снижении выработки NO клетками поврежденного эндотелия [15].
Полученные нами результаты, свидетельствующие о нарушении функции капилляров почек, было трудно экстраполировать на механизмы развития атеросклероза в магистральных сосудах, хотя общие биологические закономерности нарушения целостности эндотелия как в капиллярах почек, так и в более крупных сосудах прослеживаются, о чем говорит увеличение процента пациентов с верифицированным атеросклерозом среди больных с более выраженной альбуминурией.
Вместе с тем в предыдущей работе мы не смогли ответить на два главных вопроса:
1. Каким образом активированные нейтрофилы могут разрушить столь мощные адгезивные связи МКС?
2. Какова роль моноцитов-макрофагов в повреждении эндотелия, остается ли их основная роль прежней («чистильщик» в образовавшихся эрозиях и разрывах атеросклеротической бляшки)?
Сосудистый эндотелиальный кадгерин (VE-кадгерин) — строго эндотелиальная определенная молекула адгезии, расположенная в соединениях между эндотелиальными клетками. По аналогии с ролью E-кадгерина как главного определяющего фактора для целостности контактов эпителиоцита VE-кадгерин имеет жизненное значение для поддержания и контролирования контактов эндотелиальных клеток. Механизмы, которые регулируют VE-кадгерин-опосредованную адгезию, важны для контроля за сосудистой проницаемостью и транссудацией лейкоцитов. В дополнение к своим адгезивным функциям VE-кадгерин регулирует различные клеточные процессы, такие как пролиферация клеток, их апоптоз, и модулирует сосудистые функции рецепторов эндотелиального фактора роста [25].
Есть основания предполагать, что VE-кадгерин, являющийся главным адгезивным механизмом целостности эндотелиальных контактов, должен быть локально ослаблен, чтобы позволить лейкоциту преодолеть такой барьер. Первоначально полагали, что прикрепление нейтрофилов к человеческому эндотелиальныму монослою приводит к деградации компонентов комплексного соединения VE-кадгерин/катенин с помощью механизмов в пределах эндотелиальных клеток. Однако расширение этих исследований показало, что наблюдаемые эффекты были связаны с протеазами, выделявшимися во время приготовлений к анализу. Когда дизайн эксперимента был изменен и взаимодействия лейкоцитов с эндотелиальными монослоями были проанализированы в потоке крови, было установлено, что окрашивание комплексного соединения VE-кадгерин/катенин отсутствовало в местах эндотелиальных контактов, где произошла трансмиграция лейкоцитов [37]. Эти результаты были подтверждены видеомикроскопией и инфицированными вирус-эндотелиальными клетками VE-кадгерин-GFP или антителами, маркированными как VE-кадгерин и PECAM-1 [42]. Было сделано заключение, что VE-кадгерин может отодвигаться в сторону, как занавес, позволяя лейкоцитам проходить через соединение. Альтернативным объяснением был бы эндоцитоз. В любом случае, вероятно, что адгезивные связи VE-кадгерина открываются прежде, чем молекулы VE-кадгерина удаляются из сайтов переселения клеток. Как это регулируется полностью, еще неизвестно. Несколько публикаций сообщают о корреляциях между изменениями адгезивной стабильности VE-кадгерина и изменениями тирозинфосфориляции VE-кадгерина бета-катениновым комплексом. Увеличение слияния эндотелиальных клеток коррелировало с увеличивающейся тирозинфосфориляцией VE-кадгерина и Β-катенина, но не α-катенина [18]. Сообщалось, что нейтрофилы, стимулируемые C5a, усиливали эндотелиальную проницаемость клетки для белка и это коррелировало с увеличенной тирозинфосфориляцией VE-кадгерина и β-катенина; предполагалось, что фосфориляция тирозина самого VE-кадгерина могла бы повлиять на функции VE-кадгерина. Основываясь на исследованиях проницаемости инфицированных вирусом клеток CHO, экспрессирующих видоизмененные формы VE-кадгерина с остатками тирозина, замещенными или глутаматом, или фенилаланином, предположили участие остатков тирозина 731 и 658 в регулировании адгезивной функции VE-кадгерина [37]. Однако клетки CHO, экспрессирующие эти мутанты, связывались также с иммобилизированным VE-кадгерином-Fc как клетки CHO, экспрессирующие невидоизмененный VE-кадгерин [41]. Интригует то, что чрезмерная экспрессия мутантов при замене тирозина/фенилаланина в VE-кадгерине или тирозина 731 и 658 в эндотелиальных клетках первичной человеческой пупочной вены (HUVECs) ингибировала трансэндотелиальную миграцию лейкоцитов. Было впервые предположено, что фосфориляция специфических остатков включается в транссудацию лейкоцитов.
Опубликованные недавно работы позволяют подтвердить высказанную ранее гипотезу. Так, в работе Michael J. Allingham et al. (2007) показано, что фосфориляция белков тирозина адгезивных соединений, таких как сосудистый эндотелиальный кадгерин (VE-кадгерин) и бета-катенин, коррелирует с разрушением МКС [19]. Используя человеческие лейкоциты и эндотелиальные клетки, они продемонстрировали, что адгезия ICAM-1 приводит к активации двух киназ тирозина, Src и Pyk2, то есть участие ICAM-1 индуцирует фосфориляцию VE-кадгерина на тирозинах 658 и 731, которые относятся к p120-катенина и бета-катенина связывающим участкам соответственно. Pilar Alcaide et al. (2008) установили, что ингибирование эндотелиального Src с PP2 или SU6656 блокирует переселение нейтрофилов на 71,1 ± 3,8 и 48,6 ± 3,8 % соответственно, тогда как ингибирование эндотелиального Pyk2 также заканчивается сниженным переселением нейтрофила на 25,5 ± 6,0 % [18]. Очень похожие результаты показали P. Turowsky et al. (2008) для VE-кадгерина мыши, хотя в этом сообщении было проанализировано несколько больше мутантов тирозина VE-кадгерина, и только в точке Y731F мутантной формы VE-кадгерина диапедез лейкоцитов был ингибирован [42]. Различные факторы, как известно, усиливают сосудистую проницаемость и влияют на фосфориляцию комплексного соединения VE-кадгерин — катенин. Рецептор белкового типа тирозинфосфатаза RPTP-µ не ограничен эндотелиальными клетками и влияет на функцию различных кадгеринов. Он связывается непосредственно с эндоплазматическим хвостом VE-кадгерина и подавляет его экспрессию в человеческих эндотелиальных клетках, усиливая их проницаемость для белка. [34]. Наши клинические результаты [10, 14 ] демонстрируют, что увеличение ICAM-1 клетками белой крови — нейтрофилами и моноцитами [2, 13] — приводит к увеличению альбуминурии, следствием чего вполне может быть фосфориляция тирозина VE-кадгерина в МКС клубочковых капилляров (рис. 3).
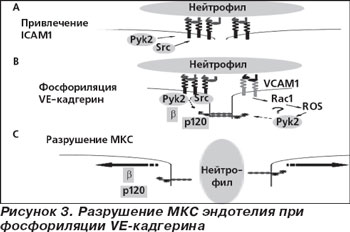
Таким образом, рекрутированные к участку повреждения эндотелия воспалительные клетки выделяют цитокины и другие провоспалительные медиаторы, которые вызывают изменения в эндотелиальных клетках локальных кровеносных сосудов, а те, в свою очередь, способствуют конверсии ткани в воспаленное состояние. В частности, ФНО-a, IL-1 и IL-6 вызывают ряд морфологических и молекулярных изменений, которые все вместе приводят к увеличенной миграции лейкоцитов и потоку плазмы к поврежденному участку [3, 6]. В большинстве случаев нейтрофилы, как клетки врожденного иммунитета, прибывают очень быстро, сопровождаемые более поздним втеканием моноцитов. Нейтрофилы поступают в воспаленный участок, вооруженные батареей эффекторных механизмов, которые могут нанести ущерб тканям сосудов. Помимо того, что они обладают гранулами, загруженными протеазами, способными к разложению фагоцитированного материала, они также производят кислородные радикалы и реактивные разновидности азота (RNS), которые денатурируют белки, разрывают липиды и повреждают ДНК [8, 35]. После поступления в зону воспаления нейтрофилы фагоцитируют любые доступные микроорганизмы и направляют содержание их гранул к этим фагосомам [9]. Если нейтрофилы обнаруживают ФНО-α, но непосредственно не сталкиваются ни с какими микробными частицами после поступления в ткани, они выделяют содержимое своих гранул во внеклеточное пространство, чтобы создать неблагоприятную среду для близлежащих повреждающих агентов. Содержание этих гранул производит значительное разрушение организменных тканей и клеток. Например, эластаза, катепсин G и протеиназа 3 являются широкоспецифичными сывороточными протеазами, которые могут разрушать компоненты внеклеточного матрикса и клетки хозяина, приводящие к расплавлению ткани [10, 33]. Эта токсичность служит для удержания повреждения в критической ранней фазе, прежде чем сработает полный иммунный ответ. Все действия нейтрофилов, однако, заканчиваются одним и тем же исходом: их гибелью путем апоптоза и удалением макрофагами. Как было упомянуто ранее, моноциты-макрофаги поступают в зону воспаления после нейтрофилов, по команде тех же самых сигналов. В дополнение к клиренсу апоптотических нейтрофилов макрофаги также вносят вклад в разложение и поглощение детрита, используя протеазы, пептиды, кислородные радикалы и RNS. Следовательно, ассоциация «кадгерин — катенин» — все еще главная цель многих исследований по определению механизма, с помощью которого целостность эндотелия нарушается при различных васкулопатиях. По-видимому, различные внутриклеточные сигнальные молекулы, фосфориляция тирозина и сывороточные остатки катенина или кадгеринов играют роль в регулировании VE-кадгерина. Подобно интегринам, кадгерины также известны как передатчики сигналов снаружи внутрь — термин, который описывает функции рецептора молекул адгезии клеток. VE-кадгерин был описан как фактор контактного торможения роста клетки, который, таким образом, противодействовал пролиферации клетки под воздействием VEGFR-2; вместе с тем он поддерживал антиапоптотические эффекты, стимулированные VEGFR-2 [40].
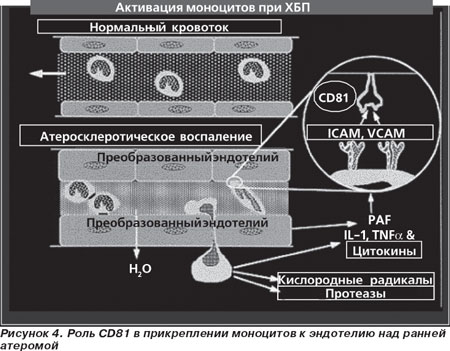
И еще одна, совсем свежая, работа из Голландии, возможно, поможет уточнить вопрос о роли моноцитов-макрофагов в развитии атеросклероза. В октябре 2008 года Jakub Rohlena et al. опубликовали работу, в которой они показали на уровне всего генома те гены, которые специфично стимулируются в эндотелии атеросклеротических бляшек человеческих артерий [28]. Поскольку полученные данные свидетельствовали о том, что мРНК CD81 значительно и специфично стимулируется в эндотелии, лежащем над ранней атеромой, они изучили функциональные последствия стимуляции CD81. Иммуногистохимический анализ в независимом наборе донорских артерий подтвердил в эндотелии ранних человеческих атеросклеротических поражений расширенную экспрессию CD81, которая носила определенную зависимость от оксидантного стресса. Авторы установили, что увеличенный уровень эндотелиальной CD81 связан с увеличенным прилипанием моноцитов к преобразованным эндотелиальным клеткам, приближаясь к уровням, обычно достигаемым только после стимуляции фактором некроза опухоли. Влияние CD81 зависело и от внутриклеточной молекулы адгезии-1 (ICAM-1), и от сосудистой молекулы адгезии клеток-1 (VCAM-1), поскольку адгезия уменьшалась в присутствии смеси антител anti-ICAM-1 и anti-VCAM-1. Проточная цитометрия показала, что увеличение уровня CD81 не увеличивало экспрессию ICAM-1 и VCAM-1. Вместо этого, как показала конфокальная и электронная микроскопия, молекулы адгезии были сконцентрированы в мембранные грозди. CD81 также был расположен вместе с ICAM-1 и VCAM-1 в адгезивном кольце, окружающем связанные моноциты. Авторы сделали заключение, что у эндотелиального CD81, активированного в ранней человеческой атероме, есть потенциал для того, чтобы играть важную роль в начальных стадиях формирования атеросклеротической бляшки, увеличивая адгезию моноцитов при уже имеющейся воспалительной реакции в эндотелии.
Таким образом, учитывая собственные результаты и данные литературы, можно сделать вывод, что в местах стенки сосудов, подвергшихся воздействию ФНО-α, IL-1 и IL-6, скапливаются ICAM-1 и VCAM-1, ослабляющие VE-кадгериновые связи и способствующие проникновению нейтрофилов, которые вместе с тучными клетками выделяют протезы, вызывая воспаление и аноикис клеток эндотелия. В эндотелии, лежащем над ранней атеромой, экспрессируются мРНК и белок CD81, которые приводят к усиленному прилипанию моноцитов и развитию атеромы (рис. 4). Эти данные подчеркивают вторичную роль моноцитов в развитии ранних атеросклеротических изменений при сердечно-сосудистых заболеваниях, что требует усиления противовоспалительных мероприятий, направленных на клетки врожденного иммунитета и адгезивные соединения.
Перспективные методы коррекции репарации и регенерации эндотелия
Классический вопрос «Кто виноват?» предполагает следующий вопрос: «Что делать?». Учитывая тот факт, что практически у всех больных с ХБП выявляется оксидантный стресс со снижением глутатионпероксидазы (у наших больных — на 19 %) и уменьшением биодоступности оксида азота — окислительный стресс и воспаление неразрывно связаны, одно порождает другое с формированием замкнутой цепи. Окислительный стресс стимулирует рецепторы клеток, которые, в свою очередь, индуцируют продукцию провоспалительных цитокинов и экспрессию адгезивных молекул: E-селектина, межклеточной адгезивной молекулы-1 (ICAM-1) и сосудистой адгезивной молекулы-1 (VCAM-1). Эти события приводят к активации лейкоцитов, инфильтрации ткани этими клетками (то есть развитию воспаления), продукции кислородных радикалов лейкоцитами и резидентными клетками (например, макрофагами, сосудистыми гладкомышечными клетками, эндотелиальными клетками и фибробластами). Окислительный стресс вызывает воспаление, которое, в свою очередь, усиливает окислительный стресс; следовательно, стратегия на уменьшение окислительного стресса и воспаления является одной из основ лечения ХБП и атеросклероза. Ранее полагали, что лечение окислительного стресса заключается в назначении антиоксидантов, способных к нейтрализации кислородных радикалов. Поэтому неудивительно, что результаты клинических испытаний антиоксидантов были неоднозначными. Несколько небольших исследований показали снижение артериального давления после назначения витаминов С и E [9, 38], но, по данным больших клинических испытаний, лечение антиоксидантами не приводило к заметному кардиопротекторному эффекту. Определенные надежды возлагаются на проходящий сейчас клинические испытания отечественный препарат корвитин/кверитин.
По-видимому, необходимо принимать во внимание несколько факторов, которые могли бы объяснить отсутствие эффективности или неблагоприятные побочные эффекты при приеме антиоксидантов. Во-первых, окислительный стресс при АГ, почечных и сердечно-сосудистых заболеваниях в связи с недостатком в организме антиоксидантов обусловлен прежде всего локальной продукцией избыточных кислородных радикалов, и назначение антиоксидантов не может оказать существенного влияния на окислительный стресс in situ. Во-вторых, антиоксиданты часто не могут проникать во внутриклеточное пространство, в котором эти кислородные радикалы синтезируются. Например, эффективность водорастворимых и жирорастворимых антиоксидантов в уменьшении окислительных реакций будет в значительной степени ограничена биохимическими свойствами мембран тех отделов клеточного пространства, где происходят соответствующие реакции. В-третьих, скорость взаимодействия между такими мощными эндогенными оксидантами, как хлорноватистая кислота или пероксинитрит (ONOO–), и молекулами-мишенями часто превышает способность антиоксидантной системы предотвращать взаимодействия. Эти очень реактивные оксиданты производятся активированными фагоцитами и являются необходимым компонентом врожденного иммунитета против внедрившихся микроорганизмов. Поэтому их биохимические действия против структурных компонентов инфекционных организмов беспрепятственно пропускаются антиоксидантной системой. По-видимому, по этой же причине окислительный стресс, вызванный неинфекционным воспалением, может быть устойчивым к терапии антиоксидантами [15, 27]. Поэтому прежде всего необходимы специфические мероприятия, направленные на коррекцию этих состояний у отдельно взятого пациента. Употребление свежих плодов и овощей, которые содержат много природных антиоксидантов в почти совершенных соотношениях, является самой надежной и самой эффективной стратегией для поддержания антиоксидантного баланса. Кроме того, регулярная физическая нагрузка стимулирует продукцию антиоксидантных ферментов, увеличивает продукцию NO, повышает чувствительность к инсулину, улучшает эндотелиальную функцию и липидный профиль с увеличением плазменных уровней липопротеидов высокой плотности [26]. Таким образом, диета и модификация образа жизни — необходимые компоненты любой стратегии по коррекции окислительного стресса и воспаления у больных ХБП и при ее осложнениях.
Нарушение функции эндотелия присутствует при всех хронических болезнях почек и сердечно-сосудистых заболеваниях. Лечение основной болезни при некоторых условиях может восстановить функцию эндотелия — у больных с хронической почечной недостаточностью пересадка почки восстанавливает и азотовыделительную функцию, и функцию эндотелия. Из фармакологических средств наиболее эффективными считаются блокаторы рецепторов ангиотензина и ингибиторы АПФ. Механизмы, посредством которых блокада ренин-ангиотензиновой системы может улучшить эндотелиальную функцию, также включают редуцирование окислительного стресса и воспаления [7]. При сахарном диабете стимуляторы γ-рецепторов активированных пролифераторов пероксисом (например, глитазоны) и активаторы α-рецепторов активированных пролифераторов пероксисом (например, фибраты) оказывают противовоспалительное и антиоксидантное воздействие и положительно влияют на эндотелиальную функцию [31]; уменьшение уровней гомоцистеина при назначении фолиевой кислоты может улучшить функцию эндотелия; миметики тетрагидробиоптерина могут улучшить эндотелиальную функцию путем увеличения биодоступности NO [21]. Недавно было показано, что ацетилсалициловая кислота может уменьшить окислительный стресс и улучшить эндотелиальную функцию. Доказано положительное влияние на эндотелиальную функцию статинов, которое может быть обусловлено как снижением содержания липидов, так и их противовоспалительным эффектом с уменьшением содержания ICAM, VCAM и увеличением экспрессии eNOS в эндотелиальных клетках [1, 4, 17]. Потенциальная защитная роль антагонистов рецептора альдостерона исследуется только в последние годы. Этот интерес связан с неожиданно положительными результатами Randomized Aldacton Evaluation Study, в котором участвовали пациенты с тяжелой хронической сердечной недостаточностью, показавшими уменьшение летальности на 30 % при назначении антагониста рецепторов альдостерона, спиронолактона, в дополнение к стандартному лечению ингибиторами АПФ. Спиронолактон в сочетании с ингибиторами АПФ снижал артериальное давление у больных сахарным диабетом, нормализуя NO-опосредованную релаксацию сосудов путем изменения баланса между NO и формированиями супероксидного аниона.
Дифференциация ЭКП и их созревание в определенных органах зависят от локальных межклеточных и клеточно-матричных взаимодействий, активации факторов роста. Установлено, что количество ЭКП в периферической крови может быть увеличено в ответ на фармакологические вмешательства, например при назначении статинов или блокаторов ангиотензиновых рецепторов [29]. В работе F. Deschaseaux et al. (2007) были представлены данные, которые показали, что количество CD34-клеток было значительно больше в статин-позитивных группах, чем в статин-отрицательных [24]. Эти результаты доказывают, что длительное лечение статинами на ранних стадиях атерогенеза оказывает воздействие на формирование в кровотоке эндотелиальных клеток-предшественников с CD34-фенотипом.
Мощным стимулятором функциональной активности и пролиферации ЭКП является также рекомбинантный человеческий эритропоэтин (rhEPO) или его аналог дарбепоэтин [21]. Выраженная стимуляция ЭКП in vitro и in vivo отмечалась даже при небольших терапевтических дозах rhEPO при лечении почечной анемии. Установлено положительное влияние на функциональные свойства эндотелия донаторов L-аргинина, агонистов пролифератора пероксисом и ω-3-ненасыщенных жирных кислот [15, 17, 39]. Вместе с тем до настоящего времени все еще нет единой точки зрения о возможности применения различных комбинаций стволовых ЭКП in vivo, нет четких критериев степени их активности, необходимы дальнейшие исследования по изучению эффективности терапевтических мероприятий, направленных на улучшение функции ЭКП.
Заключение
Исследования последних лет показали значительную роль VE-кадгерина как доминирующей молекулы адгезии, ответственной за поддержание и контроль контактов эндотелиальных клеток при многих заболеваниях сердечно-сосудистой системы; его роль в морфогенезе системы кровеносных сосудов сделала VE-кадгерин главной целью исследования среди молекул адгезии в сосудистой сети. Большие успехи были достигнуты в идентификации его сигнальных партнеров и факторов, которые влияют на его функцию. На основании наших результатов и данных литературы напрашивается ряд важных вопросов, на которые предстоит ответить в ближайшем будущем:
1. Как фосфориляция комплексного соединения «кадгерин — катенин» (например, при воздействии ICAM,VCAM и других воспалительных факторов) влияет на изменения прочности МКС-соединений в зависимости от нозологической формы и стадии заболевания?
2. Какие фармакологические препараты и до какой степени могут регулировать VE-кадгериновый барьер? Смогут ли они эффективно повлиять на процесс транссудации форменных элементов крови и своевременную замену перенесших аноикис клеток эндотелия при ХБП и атеросклерозе?
Исходя из высказанных предположений и приведенных фактов, необходимо сделать следующий вывод: поскольку количество пациентов с инфарктом миокарда, инсультом и требующих лечения с использованием диализа неуклонно увеличивается, разработка новых методов диагностики и лечения, которые обеспечат улучшение состояния больных без диализа и коронарного шунтирования, станет не только главным достижением исследователей, но и потребностью общества.
Работа была озвучена 16 октября 2008 г. в докладе на II Национальном конгрессе врачей внутренней медицины «Міждисциплінарний підхід до впровадження сучасних рекомендацій з діагностики та лікування захворювань внутрішніх органів в клінічну практику» (Киев, Украина)
1. Волков B.I., Яковлева Л.М., Бондар Т.М., Ченчик Т.О., Калашник Д.М. Дозозалежний вплив симвастатину на активність запального процесу у хворих на гострий коронарний синдром без підйому сегмента ST // Укр. кард. журнал. — 2006. — № 6. — С. 24-27.
2. Кондаков И.К., Гальчинская В.Ю., Топчий И.И., Семенових П.С., Шитова А.Б. Особенности популяционного состава лейкоцитов у больных диабетической нефропатией // Кровообіг та гемостаз. — 2006. — № 1–2. — C. 28-31.
3. Крутиков Е.С., Топчий И.И. Динамика показателей цитокинового звена иммунитета у больных, получающих хроническую гемодиализную терапию // Врачебная практика. — 2007. — № 4. — С. 68-71.
4. Синяченко О.В., Игнатенко Г.А., Мухин И.В., Грушина М.В. Сравнительная эффективность ингибиторов ГМГ-КоА редуктазы у больных хроническим гломерулонефритом без нефротического синдрома // Укр. журн. нефрології та діалізу. — 2007. — № 3. — C. 40-44.
5. Топчий И.И. Функциональные свойства макрофагов при хронической болезни почек и методы их коррекции // Врачебная практика. — 2007. — № 1. — С. 85-94.
6. Топчий И.И. Взаимодействие оксида азота, калликреин-кининовой и плазминоген-плазминовой систем как терапевтическая мишень для лечения и профилактики фиброза при хронической болезни почек // Укр. журн. нефрології та діалізу. — 2007. — № 2. — С. 2-8.
7. Топчий И.И. Окислительный стресс, повышение содержания асимметричного диметиларгинина и разобщенность NO-синтаз как факторы развития артериальной гипертензии при хронической болезни почек // Укр. тер. журн. — 2007. — № 3. — С. 8-15.
8. Топчий И.И. Эпителиально-мезенхимальная трансформация — фактор развития фиброза при хронической болезни почек у больных сахарным диабетом II типа — результат дефицита eNOS и механического стресса? // Внутрішня медицина. — 2007. — № 6 — C. 49-56.
9. Топчий И.И. Альтернативные механизмы развития артериальной гипертензии при хронической болезни почек и возможные направления их коррекции // Мистецтво лікування. — 2008. — № 2. — С. 65-70.
10. Топчий И.И. Взаимодействие макрофагов, тромбоцитов и клеток эндотелия как зеркало эволюции наших представлений об атерогенезе в кардионефрологии // Український терапевтичний журнал. — 2008. — № 1. — С. 9-18.
11. Топчий И.И., Горбач Т.В., Бондарь Т.Н. Взаимосвязь изменений антиоксидантной системы и метаболизма оксида азота у больных хронической болезнью почек с артериальной гипертензией // Серце і судини. — 2006. — № 1. — С. 89-94.
12. Топчий И.И., Горбач Т.В., Кириенко А.Н., Денисенко В.П. Влияние ω-3 ненасыщенных жирных кислот на показатели антиоксидантной системы, гемодинамику и метаболизм оксида азота у больных диабетической нефропатией с артериальной гипертензией // Кровообіг та гемостаз. — 2007. — № 3. — C. 68-72.
13. Топчий И.И., Кордеро Г.А., Шабалтас Н.Л., Кириленко А.Н., Панченко Г.Ю. Озонотерапия в комплексном лечении больных с диабетичсекой нефропатией // Експериментальна і клінічна медицина. — 2005. — № 1. — С. 69-73.
14. Топчий И.И., Тверетинов А.Б., Щербань Т.Д., Кордеро Г.А., Оксененко С.В. Влияние ренопротекторной гипотензивной терапии и ω-3 полиненасыщенных жирных кислот на воспалительный компонент диабетической нефропатии // Укр. тер. журн. — 2007. — № 2. — С. 40-46.
15. Топчій І.І., Тверетінов О.Б., Денисенко В.П., Кірієнко О.М., Бондар Т.М., Горбач Т.В. Вплив лікування на активність NO-синтаз та вміст стабільних метаболітів оксиду азоту у хворих на діабетичну нефропатию // Медицина сьогодні і завтра. — 2007. — № 2. — С. 98-102.
16. Топчий И.И., Шабалтас Н.Л., Василенко О.А. Влияние L-аргинина, S-нитрозоглутатиона и препаратов — донаторов оксида азота на функциональные свойства тромбоцитов у больных хроническим гломерулонефритом и гипертонической болезнью // Врач. практика. — 2001. — № 2. — С. 25-29.
17. Топчий И.И., Шабалтас Н.Л. Влияние препаратов — донаторов оксида азота на функциональные свойства тромбоцитов и уровень стабильных метаболитов NO у больных хроническим гломерулонефритом и гипертонической болезнью // Медицина сегодня и завтра. — 2002. — № 1. — С. 86-89.
18. Alcaide Pilar, Gail Newton, Scott Auerbach et al. p120-Catenin regulates leukocyte transmigration through an effect on VE-cadherin phosphorylation // Blood. — October 2008. — Vol. 112, № 7. — Р. 2770-2779.
19. Michael J. Allingham, Jaap D. van Buul, Keith Burridge. ICAM-1-Mediated, Src- and Pyk2-Dependent Vascular Endothelial Cadherin Tyrosine Phosphorylation Is Required for Leukocyte Transendothelial Migration? // The Journal of Immunology. — 2007. — Vol. 179. — P. 4053-4064.
20. Bahlmann F.H., De Groot K., Mueller O. Stimulation of endothelial progenitor cells. New putative therapeutic effects of angiotensin II receptor antagonists // Hypertension. — 2005. — Vol. 45. — P. 526-529.
21. Bahlmann F.H., De Groot K., Spandau J. Erythropoietin regulates endothelial progenitor cells // Blood. — 2004. — Vol. 103. — P. 921-926.
22. Boos C.J., Lane D.A., Karpha M., Beevers D.G., Haynes R. et al. Circulating endothelial cells, arterial stiffness, and cardiovascular risk stratification in Hypertension // Chest. — 2007. — Vol. 132. — P. 1540-1547.
23. Daub K., Langer H., Seizer P., Stellos K., May A.E. et al. Platelets induce differentiation of human CD34+ progenitor cells into foam cells and endothelial cells // The FASEB Journal. — 2006. — Vol. 20. — P. 2559-2561.
24. Deschaseaux F., Selmani Z., Falcoz P.-E., Mersin N., Meneveau N. Two types of circulating endothelial progenitor cells in patients receiving long term therapy by HMG-CoA reductase inhibitors // European Journal of Pharmacology. — 2007. — Vol. 562. — P. 111-118.
25. Erdbruegger U., Grossheim M., Hertel B. Diagnostic role of endothelial microparticles in vasculitis // Rheumatology Advance Access. — 2008 October 16.
26. Eiselein L., Wilson D.W., Lame M.W., Rutledge J.C. Lipolysis products from triglyceride-rich lipoproteins increase endothelial permeability, perturb zonula occludens-1 and F-actin, and induce apoptosis // Am. J. Physiol. Heart Circ. Physiol. — 2007. — Vol. 292. — P. 2745-2753.
27. Hill J.M., Zalos G., Hlacox J.P. et al. Circulating endothelial progenitor cells vascular function and cardiovascular risk // N. Engl. J. Med. — 2003. — Vol. 348. — P. 593-600.
28. Jakub Rohlena, Oscar L. Volger Jaap D. van Buul, Liesbeth H.P. Hekking et al. Endothelial CD81 is a marker of early human atherosclerotic plaques and facilitates monocyte adhesion // Cardiovascular Research Advance Access first published online on September 18, 2008. This version [Corrected Proof] published online on October 1, 2008 Cardiovascular Research, doi:10.1093/cvr/cvn 256.
29. Galchinskaya V., Semenovykh P., Topchiy I., Kondakov I., Shitova A. CD95 (Fas) expression disturbances in patients with diabetic nephropathy // The XLV ERA-EDTA Congress (Stockholm, Sweden — May 10–13 2008). Book of Abstracts. — MP147.
30. Langer H., May A.E., Daub K., Heinzmann U., Lang P., Schumm M., Vestweber D., Massberg S., Schonberger T., Pfisterer I. et al Adherent platelets recruit and induce differentiation of murine embryonic endothelial progenitor cells to mature endothelial cells in vitro // Circ. Res. — 2005. — Vol. 98. — P. 2-10.
31. Li A.C., Binder C.J., Gutierrez A., Brown K.K., Plotkin C.R. et al. Differential inhibition of macrophage foam-cell formation and atherosclerosis in mice by PPAR alpha, beta/delta, and gamma // J. Clin. Invest. — 2004. — Vol. 114. — P. 1564-1576.
32. Malyszko J., Malyszko J.S., Kozminski P., Pawlak K., Mysliwiec M. Adipokines, linking adipocytes and vascular function in hemodialyzed patients may also be possibly related to CD146, a novel adhesion molecule // Clin. Appl. Thromb. Hemost. — 2007. — Vol. 26. — P. 17-23.
33. Mayranpaa M.I., Heikkila H.M., Lindstedt K.A., Walls A.F., Kovanen P.T. Desquamation of human coronary artery endothelium by human mast cell proteases: implications for plaque erosion // Coronary Artery Disease. — 2006. — Vol. 17. — P. 611-621.
34. Peltier J., Bellocq A., Perez J. Calpain activation and secretion promote glomerular injury in experimental glomerulonephritis: evidence from calpastatin-transgenic mice // J. Am. Soc. Nephrol. — 2006. — Vol. 17, № 12. — P. 3415-3423.
35. Roberts C.K. Oxidative stress and dysregulation of NAD(P)H oxidase and antioxidant enzymes in diet-induced metabolic syndrome // Metabolism. — 2006. — Vol. 55. — P. 928-934.
36. Schmidt-Lucke C., Rossig L., Fichtlscherer S., Vasa M., Britten M. Reduced number of circulating endothelial progenitor cells predicts future cardiovascular events: proof of concept for the clinical importance of endogenous vascular repair // Circulation. — 2005. — Vol. 111. — P. 2981-2987.
37. Serban Doinita, Leng Jie, Cheresh David. H-Ras Regulates Angiogenesis and Vascular Permeability by Activation of Distinct Downstream Effectors // Circulation Research. — 2008. — Vol. 102. — P. 1350.
38. Tian N. Antioxidant treatment prevents renal damage and dysfunction and reduces arterial pressure in salt-sensitive hypertension // J. Hypertens. — 2005. — Vol. 45. — P. 934-939.
39. Werner N., Kosiol S., Schiegl T., Ahlers P., Walenta K. et al. Circulating endothelial progenitor cells and cardiovascular outcomes // N. Engl. J. Med. — 2005. —Vol. 353. — P. 999-1007.
40. Xu Q. The impact of progenitor cells in atherosclerosis // Nat. Clin. Pract. Cardiovasc. Med. — 2006. — Vol. 3. — P. 94-101.
41. Potter M.D., Barbero S., Cheresh D.A. Tyrosine phosphorylation of VE-cadherin prevents binding of p120- and beta-catenin and maintains the cellular mesenchymal state // J. Biol. Chem. — 2005. — Vol. 280. — P. 31906-31912.
42. Turowski P., Martinelli R., Crawford R. et al. Phosphorylation of vascular endothelial cadherin controls lymphocyte emigration // J. Cell Sci. — 2008, in press.
