Журнал «Внутренняя медицина» 5-6(11-12) 2008
Вернуться к номеру
Мілринон: огляд клінічної ефективності й рекомендацій із використання в сучасній кардіології та кардіохірургії
Авторы: О.В. Лапшин, Ю.В. Березняк, Національна медична академія післядипломної освіти ім. П.Л. Шупика, м. Київ, Дорожня клінічна лікарня № 2 м. Києва
Рубрики: Семейная медицина/Терапия, Терапия
Версия для печати
Вступ
Мілринон є біпіридиновим похідним амринону, позитивним інотропом із вазодилататорною та люзитропною дією. Перші офіційні публікації щодо клінічного досвіду використання Мілринону з’явилися 1983 року [5, 6]. Цікаво, що, незважаючи на продовження досліджень цього препарату, точно механізм його дії тривалий час залишався нез’ясованим. Тільки 1988 року в роботах Ito et al. було показано, що Мілринон є потужним селективним інгібітором кардіальної фосфодіестерази типу III, що призводить до зростання концентрації інтрацелюлярної цАМФ та зміни транспорту кальцію зі збільшенням його внутрішньоклітинного вмісту [16].
Фармакокінетика Мілринону
У дослідженнях на здорових добровольцях було продемонстровано, що час напіввиведення Мілринону, який застосовувався внутрішньовенно (в/в), становить 0,8 години, при пероральному прийманні 79,9–84,5 % загальної дози препарату виводиться з сечею протягом перших 24 годин [2].
Середній час напіввиведення Мілринону при в/в використанні в пацієнтів із тяжкою застійною серцевою недостатністю (ЗСН) становить 1,7 години [9]. У цьому ж дослідженні середній кліренс Мілринону з плазми становив 0,15 ± 0,03 л/кг/хв, об’єм розподілу — 0,35 ± 0,02 л/кг.
При пероральному прийманні Мілринону в здорових осіб 82 % виводиться з сечею, нирковий кліренс становить 288 мл/хв, а час напівжиття в плазмі — 0,94 години. У пацієнтів із помірною нирковою недостатністю час напіввиведення зростає до 1,78 години, із тяжкою — до 3,24 години. За даними Edelson et al. (1986), час напіввиведення Мілринону як при пероральному, так і парентеральному використанні становить приблизно 2 години, об’єм розподілу — приблизно 400–500 мл/кг і загальний кліренс — 130 мл/кг/год. Виведення Мілринону було швидшим у здорових добровольців, ніж у пацієнтів із ЗСН [10].
Гемодинамічні ефекти Мілринону в пацієнтів із застійною серцевою недостатністю
У дослідженнях на тваринних моделях препарат показав суттєве покращення контрактильної функції міокардіоцитів [3, 4]. Також на тваринних моделях було показано, що Мілринон має периферичні вазодилатуючі властивості, пригнічує АДФ- [18, 21] та тромбініндуковану [64] агрегацію тромбоцитів, викликає супресію інгібітору активатора плазміногену-1 [55].
Порівняно зі своїм попередником амриноном Мілринон продемонстрував у 10–30 разів вищу інотропну ефективність і не викликав тромбоцитопенії та гарячки в дослідженнях на здорових добровольцях [1, 4].
Anderson et al. (1987) провели досить велике багатоцентрове дослідження, у якому порівнювали ефективність різних доз 48-годинної в/в інфузії Мілринону [13]. Мілринон вводився болюсно (мкг/кг/10 хв), а потім у підтримуючій дозі (мкг/кг/хв). У дослідження було включено 189 пацієнтів із ЗСН ФК III–IV за NYHA і серцевим індексом ≤ 2,5 л/хв/м2 або тиском заклинювання легеневих капілярів (ТЗЛК) ≥ 15 мм рт.ст. Пацієнти були рандомізовані на 4 групи залежно від дози Мілринону (болюсно/підтримуюча доза): 37,5/0,375 (низька доза, n = 26), 50/0,50 (середня доза, n = 95), 75/0,75 (висока доза, n = 15) і 50/0,25 (найнижча доза, n = 53). У всіх пацієнтів проводився безперервний гемодинамічний моніторинг. Найнижча доза підтримуючої терапії виявилася неефективною. Ефективним введення Мілринону вважалося, якщо воно сприяло збільшенню серцевого індексу принаймні на 20 % та/або зменшенню тиску заклинювання легеневих капілярів принаймні на 20 %. Під час перших 3 годин лікування ефективна відповідь спостерігалася в 90 % пацієнтів. Протягом 2 днів лікування середня ефективна відповідь реєструвалася у 80 % пацієнтів із чіткою дозозалежною тенденцією (69 % пацієнтів відповіли на низьку дозу, 80 % — на середню, 93 % — на високу). При будь-якій навантажувальній дозі ефект спостерігався протягом перших 15 хвилин. Початковий серцевий індекс збільшився на 24–42 % у всіх пацієнтів із трьох груп лікування, тоді як тиск заклинювання легеневих капілярів зменшився на 24–33 %. Початкове зменшення системного судинного опору становило 15–31 %. Початкові зміни ЧСС (від +4 до +13 %) і середнього артеріального тиску (від –2 до –13 %) були помірними. Вірогідні гемодинамічні зміни зберігалися протягом 48 годин лікування. Підвищення серцевого індексу в 1-й і 2-й дні становило відповідно 38 і 39 % у групі низької дози, 34 і 37 % — у групі середньої дози і 73 і 44 % — високої дози. Зменшення тиску заклинювання для всіх пацієнтів становило від 18 до 32 % і не залежало чітко від дози. Зміни ЧСС були помірними й варіабельними: від –9 до +9 %.
У канадському багатоцентровому дослідженні вивчалися гемодинамічні ефекти 48-годинної в/в інфузії Мілринону в 105 пацієнтів зі стабільною ЗСН ФК III–IV за NYHA [19]. Мілринон вводився в навантажувальній дозі 50 мкг/кг із подальшою інфузією 0,5 мкг/кг/хв. Введення навантажувальної дози призводило до 28% зниження ТЗЛК (p < 0,001), 38% підвищення серцевого індексу (р < 0,001) та 34% збільшення індексу ударного об’єму (р < 0,001) протягом 15 хвилин. Інфузія Мілринону дозволяла зберігати 27 і 24% зниження ТЗЛК протягом 1-ї та 2-ї доби відповідно (р < 0,001). Серцевий індекс був підвищений на 32 і 34 % протягом того ж інтервалу часу (р < 0,001). Не спостерігалося клінічно вірогідних змін ЧСС або середнього АТ протягом періоду дослідження. Загалом Мілринон добре переносився. Із 105 пацієнтів 1 пацієнт помер після передчасного припинення інфузії Мілринону, а в 2 пацієнтів швидкість інфузії була знижена у зв’язку з розвитком надшлуночкових аритмій.
Цікаве дослідження було проведене Klocke et al. (1991), які оцінювали зміни гемодинаміки в пацієнтів із тяжкою насосною недостатністю (n = 18), у тому числі з кардіогенним шоком, і порівнювали їх зі змінами у менш тяжко хворих пацієнтів (n = 22). Через 15 хвилин після початку інфузії Мілринону підвищення серцевого індексу в середньому становило 45 %, тоді як у підгрупі найтяжчих пацієнтів — 94 % через 15 хвилин і 106 % — через 30 хвилин. ТЗЛК знижувався аналогічно в усіх пацієнтів незалежно від тяжкості стану. ЧСС мала тенденцію до збільшення. У підгрупі пацієнтів із найтяжчою формою ЗСН, у яких початковий АТ був низьким, спостерігалася тенденція до його зростання через 1 годину після початку інфузії Мілринону, ЗСН продовжувала наростати протягом перших 24 годин. Побічних ефектів, розвитку резистентності до препарату автори не спостерігали [23].
Проаритмогенні ефекти Мілринону
З огляду на те, що Мілринон — не катехоламіновий, не глікозидний препарат, а також на його ізотропний вплив було висловлено припущення про можливу активацію проатерогенних механізмів при його хронічному застосуванні.
У дослідженні Anderson et al. (1986), у якому вивчали проаритмогенні ефекти Мілринону при в/в застосуванні, результати були більш оптимістичними [11]. Мілринон вводився в початковій дозі 37,5–75 мкг/кг/10 хв із подальшою підтримуючою інфузією в дозі 0,25–0,75 мкг/кг/хв протягом 48 годин. Усього в дослідженні брали участь 12 пацієнтів із хронічною серцевою недостатністю, переважно неішемічної етіології, і фракцією викиду лівого шлуночка (ФВЛШ) 21 %; середній вік становив 58 років. Спостерігалися типові для Мілринону гемодинамічні ефекти — зростання серцевого індексу, зменшення тиску заклинювання капілярів. Протягом періоду лікування стійких тахіаритмій не було. Частота шлуночкових екстрасистол становила 87 ± 48 на годину до лікування і 141 ± 69 на годину — після нього (р = 0,08). Середня частота куплетів становила 6,0 ± 4,9 на годину до лікування і 14,3 ± 11,0 на годину протягом інфузії (р = 0,21). Середня частота пробіжок становила 0,9 ± 0,8 на годину до лікування і 2,7 ± 2,4 на годину протягом інфузії (р = 0,29). У 2 пацієнтів спостерігалося досягнення критеріїв проаритмії. Отже, в/в інфузія Мілринону в пацієнтів із переважно неішемічною етіологією ЗСН може бути достатньо ефективною та безпечною.
Ludmer et al. (1987) провели ретроспективну оцінку проаритмогенних ефектів Мілринону в 74 пацієнтів із ЗСН ФК III–IV за NYHA, які приймали препарат перорально принаймні 1 тиждень [14]. Оцінка проводилася за допомогою 24-годинного холтерівського моніторингу ЕКГ. У 85 % пацієнтів не спостерігалося суттєвих змін, у 6 % відзначалося вірогідне зменшення щільності шлуночкових куплетів і частоти шлуночкових тахіаритмій. У 9 % пацієнтів частота складних шлуночкових аритмій вірогідно збільшилася. Загальні рівні кардіальної смертності й раптової кардіальної смерті протягом 6 місяців спостереження не відрізнялися по групах лікування.
У канадському багатоцентровому дослідженні 48-годинної в/в інфузії Мілринону в пацієнтів зі стабільною ЗСН ФК III–IV за NYHA проводився холтерівський моніторинг ЕКГ у 47 пацієнтів до та під час інфузії. Автори виявили вірогідне збільшення кількості шлуночкових екстрасистол, куплетів та пробіжок під час лікування Мілриноном (р < 0,001) [19].
Разом із тим було встановлено, що для купірування тахіаритмій, асоційованих із використанням Мілринону, досить ефективними є внутрішньовенні бета-блокатори (метопролол, емолол) [43].
Можливості комбінації з іншими інотропами
У дослідженні Brown et al. (1986) на ізольованих м’язових волокнах було показано, що оубаїн (G-строфантин) потенціює інотропні ефекти Мілринону [12]. У дослідженні Bohm et al. (1988) було показано, що попередня обробка м’язових волокон міокарда ізопреналіном у пацієнтів із ЗСН ФК II–IV за NYHA призводила до посилення інотропної дії Мілринону, що принаймні теоретично може свідчити про можливу клінічну ефективність комбінованого застосування катехоламінергічних препаратів (ізопреналін) та інгібіторів фосфодіестерази (Мілринон) у пацієнтів із термінальними стадіями ЗСН [17].
Colucci et al. (1988) показали, що інотропний ефект інтракоронарного введення добутаміну посилюється при попередньому інтракоронарному введенні Мілринону [15]. Meissner et al. (1992) показали, що комбіноване лікування 14 пацієнтів із ЗСН ФК III–IV за NYHA Мілриноном в/в (0,5 мкг/кг/хв) і добутаміном (до 9 мкг/кг/хв) порівняно з монотерапією добутаміном підвищувало індекс ударного об’єму, сприяло додатковому зниженню ТЗЛК, системного й легеневого судинного опору [28].
Отже, перші етапи дослідження Мілринону протягом 1983–1991 рр. показали, що він має в 10–30 разів вищу інотропну ефективність порівняно з прототипом (амринон), чіткі вазодилатуючі властивості. Важливість останніх для лікування пацієнтів із застійною серцевою недостатністю залишалася нез’ясованою. Механізм дії Мілринону пов’язаний з селективною інгібіцією кардіальної фосфодіестерази з подальшим підвищенням концентрації внутрішньоклітинного цАМФ та змінами транспорту кальцію. Був накопичений клінічний досвід коротко- та довготривалого використання препарату в обмеженої кількості пацієнтів із застійною серцевою недостатністю, що була рефрактерна до традиційної терапії. Мілринон зазвичай призначався у внутрішньовенних болюсних дозах (12,5–75,0 мкг/кг) та/або у вигляді постійної внутрішньовенної інфузії (0,5 мкг/кг/хв) або перорально (30–40 мг/добу за декілька приймань). Мілринон швидко покращує серцеву функцію за рахунок посилення скоротності міокарда та зменшення системного судинного опору (післянавантаження), лівошлуночкового тиску наповнення (пренавантаження) і легеневого артеріального тиску. Підвищення толерантності до фізичних навантажень виникає одночасно з покращенням лівошлуночкової функції, але без збільшення споживання міокардом кисню та без суттєвого зниження середнього артеріального тиску. Мілринон порівнювався з добутаміном, нітропрусидом і каптоприлом у попередніх короткотривалих дослідженнях на пацієнтах із тяжкою ЗСН. Мілринон вірогідно збільшує індекс ударної роботи та зменшує лівошлуночковий тиск наповнення порівняно з нітропрусидом. При порівнянні з добутаміном було виявлено, що обидва препарати покращували серцевий індекс (однаковою мірою), але Мілринон вірогідно зменшував правопередсердний тиск, тиск заклинювання легеневих капілярів і лівошлуночковий кінцево-діастолічний тиск. В одному невеликому дослідженні було показано, що короткотермінові ефекти в/в використання Мілринону можуть бути більшими, ніж при пероральному прийманні каптоприлу, і додавання каптоприлу до лікування Мілриноном може призводити до потенціювання гемодинамічних ефектів. Попередні довготривалі дослідження свідчать, що препарат добре переноситься без розвитку серйозних побічних ефектів (у першу чергу тромбоцитопенії, гарячки і шлунково-кишкових розладів, які часто спостерігалися при застосуванні амринону). Однак не було показано, що Мілринон покращує прогноз захворювання або зменшує загальну смертність. Також не були остаточно з’ясовані ймовірні аритмогенні ефекти Мілринону.
Використання Мілринону в кардіохірургії
Feneck (1991) від імені Європейської багатоцентрової дослідницької групи повідомив про результати використання Мілринону в 99 пацієнтів із низьким серцевим викидом (серцевий індекс < 2,5 л/хв/м2) і адекватним тиском наповнення (ТЗЛК > 8 мм рт.ст.), яким проводилися кардіохірургічні втручання. Пацієнти отримували Мілринон у навантажувальній дозі (50 мкг/кг протягом 10 хв) і переходили на в/в інфузію в дозі 0,375; 0,5 або 0,75 мкг/кг/хв протягом принаймні 12 годин. Лікування Мілриноном супроводжувалося достатньо швидким, стійким і вірогідним збільшенням серцевого індексу та зменшенням ТЗЛК у всіх групах (р < 0,001). У всіх пацієнтів збільшувалася ЧСС (р < 0,001). Побічні ефекти спостерігалися рідко. Автори дійшли висновку, що в/в застосування Мілринону є ефективним і безпечним методом лікування при низькому серцевому викиді при кардіохірургічних утручаннях [24]. Аналогічні результати спостерігалися і в інших дослідженнях [25, 26, 40, 41].
De Hert et al. (1995) показали, що Мілринон може використовуватися для припинення серцево-легеневого шунтування після кардіохірургічних утручань [31]. При цьому оптимальним є його введення в дозі 20 мкг/кг протягом 15 хвилин. Використання Мілринону під час кардіохірургічних утручань не спричиняє суттєвих змін у кількості та функції тромбоцитів, що може бути достатньо критичним у даній популяції пацієнтів, зважаючи на підвищений ризик періоперативних кровотеч [32]. Розвиваючи цей напрямок, Doolan et al. (1997) провели подвійне сліпе плацебо-контрольоване дослідження використання Мілринону для припинення серцево-легеневого шунтування в 32 пацієнтів із ФВЛШ ≤ 35 % та/або середнім тиском у легеневій артерії ≥ 20 мм рт.ст. [38]. Мілринон вводився у навантажувальній дозі 50 мкг/кг протягом 20 хвилин, надалі — 0,5 мкг/кг/хв. Введення препарату розпочиналося за 15 хвилин до припинення шунтування. 2 пацієнти були виключені з дослідження, і їх дані не ввійшли до остаточного аналізу: один — через проблеми з моніторуванням гемодинаміки, один — через серйозну хірургічну кровотечу. Успішно припинити шунтування вдалося в 15 осіб із групи Мілринону й тільки у 5 з 15 пацієнтів із групи плацебо. У 10 пацієнтів із групи плацебо, у яких не вдалося відразу припинити шунтування, воно було розпочате знову, і їм було призначено Мілринон у відкритому режимі. Їх також вдалося після цього зняти з шунтування. Щодо гемодинамічних результатів, то автори зазначають про суттєвіше, ніж у групі плацебо, зростання серцевого індексу. Orime et al. (1998) у дослідженні на 24 пацієнтах, яким проводилося аортокоронарне шунтування (АКШ), показали, що додавання Мілринону в/в у дозі 0,25 мкг/кг/хв до інфузії добутаміну та допаміну в низьких дозах суттєво збільшує серцевий індекс, зменшує індекс системного судинного опору, допомагає легше знімати пацієнтів із серцево-легеневого шунтування [45]. Lobato et al. (1998) показали, що в/в введення Мілринону в разовій дозі 50 мкг/кг у пацієнтів із раніше існуючою лівошлуночковою дисфункцією також дозволяє суттєво полегшити перехід пацієнта з серцево-легеневого шунтування [46]. Yamada et al. (2000) показали, що Мілринон у комбінації з норадреналіном може бути ефективною альтернативою адреналіну при припиненні серцево-легеневого шунтування в пацієнтів із низьким серцевим індексом перед оперативним утручанням [53]. Kim et al. (2003) показали, що використання Мілринону під час проведення АКШ без екстракорпорального кровообігу в пацієнтів з ішемічною хворобою серця, які регулярно приймають бета-блокатори (атенолол 100 мг/добу), суттєво покращує серцевий викид, зменшує системний судинний опір, потребу в додатковому використанні допаміну [70].
Одним із позитивних аспектів використання Мілринону при кардіохірургічних утручаннях є пригнічення продукції цитокінів унаслідок збільшення концентрації цАМФ [48], покращення кровообігу у внутрішній грудній артерії, що використовується як шунт при АКШ [49]. Також у післяопераційному періоді в пацієнтів, які отримували Мілринон під час операції, зменшувалася кислотність у слизовій шлунка, менш виражене підвищення інтерлейкіну-6, кількості лейкоцитів [56], збільшувався церебральний кровообіг унаслідок дилатації судин головного мозку [62]; препарат справляв позитивний вплив на анаеробний тканинний метаболізм, що відображалося зниженням рівня сироваткового лактату, глюкози й зменшення надлишку лугів.
Іншою проблемою, яка виникає в пацієнтів після кардіолегеневого шунтування, є пригнічення міокардіальної скорочувальної функції, що може спостерігатися навіть у пацієнтів з відносно нормальними показниками до оперативного втручання. Butterworth et al. (1995) вивчали можливість корекції постоперативної міокардіальної дисфункції при в/в використанні Мілринону, порівнюючи ефективність трьох різних болюсних доз. Найбільш оптимальною з точки зору балансу ефективності/безпечності виявилася доза Мілринону 50 мкг/кг, що вводилася в/в болюсно протягом 60 с [33]. За даними Kikura, Sato (2001), профілактичне введення Мілринону в дозі 50 мкг/кг болюсно з подальшою інфузією 0,5 мкг/кг/хв є ефективним для запобігання розвитку постопераційних дисфункцій лівого шлуночка [61].
Отже, використання Мілринону в кардіохірургічній практиці є досить перспективним методом лікування та профілактики низького серцевого викиду при оперативних утручаннях, а також може використовуватися для прискорення переходу з серцево-легеневого шунтування на самостійний кровообіг.
Мілринон у педіатричній практиці
Chang et al. (1995) вивчали можливість використання Мілринону при низькому серцевому викиді в педіатричній кардіохірургії. У групі дослідження було 10 дітей, середній вік — 5 днів (3–27 днів), середня маса тіла — 3,7 кг (2,0–4,8 кг). Оперативні втручання проводилися з приводу транспозиції великих артерій (n = 6), тетради Фалло (n = 2) та інших уроджених пороків (n = 2). Мілринон вводився в/в болюсно в дозі 50 мкг/кг протягом 15 хвилин з подальшою в/в інфузією 0,5 мкг/кг/хв протягом 30 хв. Автори виявили, що препарат суттєво знижує тиски наповнення, системний і легеневий артеріальний тиск та системний і легеневий судинний опір, підвищує при цьому серцевий індекс і не змінює споживання кисню міокардом [34].
Barton et al. (1996) показали, що Мілринон у стандартному режимі дозування (50 мкг/кг болюсно + інфузія 0,05 мкг/кг/хв протягом 2 годин) підвищує серцевий індекс, знижує ТЗЛК, системний судинний опір у дітей віком 9 міс. — 15 років з негіпердинамічним септичним шоком. Мілринон використовувався разом із катехоламінами. Побічних ефектів у даному дослідженні не було [37].
Ramamoorthy et al. (1998) показали, що Мілринон у дітей, які були піддані кардіохірургічним утручанням, виводиться швидше, ніж у дорослих. Також вони відзначали значно високий рівень тромбоцитопеній (58 %), хоча через відсутність контрольної групи важко оцінити, була пов’язана тромбоцитопенія з застосуванням Мілринону чи інших препаратів або з проведенням екстракорпорального шунтування під час оперативного втручання тощо [42]. В іншому дослідженні було показано, що при в/в інфузії тромбоцитопенія в дітей частіше спостерігається при використанні амринону, ніж Мілринону [44].
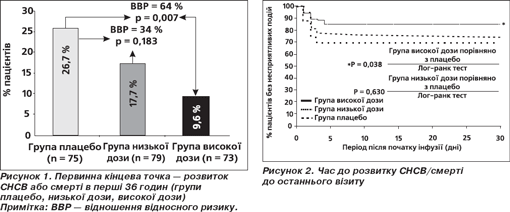
Дослідження PRIMACORP. Синдром низького серцевого викиду (СНСВ) виникає у 25 % немовлят та маленьких дітей після проведення кардіохірургічних утручань, роблячи суттєвий внесок до постопераційної захворюваності й смертності. Пілотні гемодинамічні дослідження Мілринону в дітей простимулювали подальший інтерес до вивчення препарату в даної популяції пацієнтів. У дослідженні PRIMACORP оцінювалися ефективність і безпечність профілактичного введення Мілринону в педіатричних пацієнтів із високим ризиком розвитку СНСВ [66]. Дослідження мало подвійний сліпий плацебо-контрольований дизайн із 3 паралельними групами: група використання низької дози Мілринону (25 мкг/кг болюсно протягом 60 хвилин з подальшою інфузією 0,25 мкг/кг/хв протягом 35 годин), група високої дози Мілринону (75 мкг/кг болюсно з подальшою інфузією 0,75 мкг/кг/хв протягом 35 годин) і група плацебо. Кінцева точка смерті та розвитку синдрому низького серцевого викиду оцінювалася на 36-ту годину та через 30 днів після рандомізації. Серед 238 пролікованих пацієнтів частота СНСВ протягом перших 36 годин становила 25,9 % у групі плацебо, 17,5 % — у групі низьких доз Мілринону і 11,7 % — у групі високих доз. Високі дози Мілринону суттєво зменшували ризик розвитку СНСВ порівняно з плацебо, зниження відносного ризику становило 55 % (р = 0,023) у 238 пролікованих пацієнтів і 64 % (р = 0,007) у 227 пацієнтів без суттєвих відхилень від протоколу. 2 пацієнти померли, обидва після інфузії досліджуваного препарату. Використання високих доз Мілринону зменшило ризик СНСВ до моменту останнього візиту на 48 % (р = 0,049). Отже, автори дійшли висновку, що профілактичне використання Мілринону в дозі 75 мкг/кг болюсно з подальшою інфузією 0,75 мкг/кг/хв зменшує ризик СНСВ у педіатричних пацієнтів, які оперуються з приводу уроджених пороків серця. При цьому типових для дорослих пацієнтів ускладнень (гіпотензія, аритмія, тромбоцитопенія) практично не спостерігається (рис. 1, 2).
Лікування гострої серцевої недостатності
Особливістю Мілринону є те, що його дія не залежить від стимуляції бета-адренорецепторів, які в багатьох пацієнтів із декомпенсованою ЗСН мають знижену чутливість. Цим, зокрема, обумовлюється рефрактерність гострої ЗСН при лікуванні такими бета-адреностимуляторами, як допамін чи добутамін. Domіnguez de Rozas et al. (1994) провели дослідження гемодинамічних ефектів Мілринону в 13 пацієнтів (11 чоловіків, 2 жінки, середній вік — 55 ± 12 років) із декомпенсованою СН і резистентністю до допаміну, добутаміну та/або нітропрусиду [30]. Мілринон вводився в/в у початковій дозі 50 мкг/кг протягом 10 хвилин із подальшою інфузією 0,75 мкг/кг/хв протягом 6 годин. Автори спостерігали вірогідне збільшення серцевого індексу та ударного об’єму (на 40 і 28 % відповідно) (р < 0,05). Вірогідно зменшувалися параметри системного та легеневого судинного опору (на 17 і 30 % відповідно) (р < 0,05). Мілринон добре переносився, і серйозних побічних ефектів не спостерігалося. Отже, у пацієнтів, рефрактерних до добутаміну, допаміну, Мілринон суттєво покращує параметри систолічної функції лівого шлуночка.
Karlsberg et al. (1996) проводили дослідження ефективності Мілринону при лікуванні серцевої недостатності після гострого інфаркту міокарда [36]. У дослідження було включено 33 пацієнтів із ЗСН ФК II–III за NYHA через 12 годин — 5 днів після гострого інфаркту міокарда. Дослідження мало відкритий характер, і препаратом порівняння в ньому був добутамін. Усі пацієнти отримували інфузію одного з препаратів протягом 24 годин. Критерієм ефективності було збільшення серцевого індексу принаймні на 30 % або зменшення ТЗЛК понад 25 %. Підвищення серцевого індексу спостерігалося в обох групах, тоді як ефективність за ТЗЛК спостерігалася в 94 % пацієнтів із групи Мілринону та 57 % — із групи добутаміну (р = 0,03). Обидва препарати добре переносилися.
Zewail et al. (2003) провели дослідження ефективності інфузії Мілринону в 65 пацієнтів із тяжкою ЗСН ФК IV за NYHA і ФВЛШ < 25 %, які були рефрактерними до традиційної пероральної терапії [68]. Усім пацієнтам розпочиналася довготривала в/в інфузія Мілринону. Середня тривалість терапії Мілриноном у цій групі пацієнтів становила 269 днів (14–1026 днів). У 51 пацієнта вдалося розпочати терапію пероральними бета-блокаторами. Функціональний клас ЗСН покращився при прийманні Мілринону з IV до ІІ–ІІІ. У 24 пацієнтів удалося відтитрувати дозу бета-блокатора до цільової та інфузію Мілринону припинити. 16 (31 %) пацієнтів померли під час комбінованого лікування: 1 пацієнт унаслідок раптової кардіальної смерті на 116-й день лікування, 15 пацієнтів — унаслідок прогресування серцевої недостатності або інших ускладнень. Частота госпіталізацій за 6 місяців до лікування і протягом 6 місяців від початку терапії Мілриноном залишалася однаковою. Загальна кількість днів у лікарні зменшилася з 450 до 380 (на 15,6 %), а середня тривалість перебування в лікарні — на 1,4 дня (на 14,7 %). Отже, лікування Мілриноном і бета-блокаторами є ефективним способом терапії навіть при поступовому підвищенні дози бета-блокатора, після досягнення цільової дози інфузію Мілринону часто вдається припинити, функціональний статус пацієнта покращується при комбінованому режимі лікування, і раптова кардіальна смерть під час лікування є відносно нечастою подією.
Zeng et al. (2000) провели оцінку ефективності в/в інфузії Мілринону в 30 пацієнтів із ЗСН ФК III–IV за NYHA [65]. Дослідження мало рандомізований подвійний сліпий плацебо-контрольований дизайн — по 15 пацієнтів у групі Мілринону і плацебо. Дослідники повідомляють, що в групі Мілринону спостерігалося вірогідне підвищення ударного об’єму, серцевого індексу, серцевого викиду та фракції викиду ЛШ (з 23 ± 5 % до 35 ± 6 %, р < 0,001). У групі плацебо змін гемодинаміки не було. Мілринон позитивно впливав на симптоматику й серцеву функцію в 73,3 % пацієнтів, тоді як плацебо — у 26,7 % (р < 0,05).
Дослідження OPTIME-CHF. Оскільки більшість досліджень, у яких вивчалися гемодинамічні ефекти Мілринону при декомпенсованій ЗСН, були невеликими, практично ніколи не включали групу контролю (плацебо), було вирішено перевірити його ефективність та вплив на перебіг захворювання в багатоцентровому рандомізованому плацебо-контрольованому дослідженні. Усього в дослідження було залучено 951 пацієнта з ФВЛШ < 40 % протягом року до початку дослідження, які госпіталізовувалися з приводу загострення хронічної серцевої недостатності, що виникло за 48 годин до госпіталізації. Пацієнти були рівномірно розподілені на групи Мілринону (n = 472) і плацебо (n = 479). Мілринон вводився без початкового болюсу в дозі 0,5 мкг/кг/хв, і залежно від рішення лікаря доза могла бути знижена до 0,375 мкг/кг/хв при розвитку гіпотензії або підвищена до 0,75 мкг/кг/хв при нормальній переносимості препарату. Тривалість інфузії становила 48 годин, і вона могла бути продовжена до 72 годин за рішенням лікаря. Особливістю даного дослідження було те, що всім дослідникам було надано рекомендації щодо активної титрації дози інгібітору АПФ до максимальної терапевтичної протягом періоду госпіталізації (на практиці це, як правило, потребує декілька тижнів або місяців). Період спостереження в цьому дослідженні становив 60 місяців. Основною кінцевою точкою ефективності була загальна кількість днів у лікарні протягом 60 днів після рандомізації; вторинні кінцеві точки включали частоту неуспішності лікування внаслідок розвитку побічних ефектів або погіршення серцевої недостатності протягом 48 годин від початку лікування; частку пацієнтів, які досягли цільової дози інгібітору АПФ; час, необхідний для досягнення цільової дози; симптоматику; покращення бала серцевої недостатності; тривалість госпіталізації з приводу серцево-судинних подій від моменту виписки з лікарні до 60-го дня; тривалість госпіталізації протягом 30 днів після рандомізації; госпіталізації з будь-яких причин та смертність.
Групи лікування були достатньо збалансованими. Середній вік пацієнтів становив 66 ± 14 років у групі плацебо, 65 ± 15 років — у групі Мілринону; частка чоловіків складала 68,0 і 64,2 % відповідно. Пацієнти з групи Мілринону дещо частіше госпіталізовувалися з приводу кардіальних причин протягом 1 року до дослідження, ніж пацієнти з групи плацебо (2,1 ± 2,2 раза проти 1,9 ± 2,0 раза, р < 0,05). Частота використання фармакологічних та механічних інтервенцій була однаковою в різних групах пацієнтів, однак у групі плацебо використання в/в діуретиків на 48-му годину лікування було частішим, ніж у групі Мілринону (82,2 проти 76,9 %, р = 0,02). За первинною кінцевою точкою відмінностей між групами лікування не спостерігалося — 12,5 ± 14,0 дня госпіталізації у групі плацебо проти 12,3 ± 14,1 дня в групі Мілринону (р = 0,71). За більшістю вторинних кінцевих точок статистично вірогідних відмінностей також не спостерігалося, включаючи рівень 60-денної смертності — 8,9 і 10,3 % відповідно (р = 0,41). За однією з використовуваних шкал оцінки суб’єктивного статусу в групі Мілринону самопочуття пацієнтів було вірогідно кращим на 30-й день із початку лікування, однак відмінності нівелювалися на 60-й день. У групі Мілринону спостерігалася вірогідно вища кількість побічних реакцій — надшлуночкових тахіаритмій (4,6 проти 1,5 % у групі плацебо, р = 0,004), стійкої гіпотензії (10,7 проти 3,2 % у групі плацебо, р < 0,001).
Продовжуючи аналіз даних дослідження OPTIME-CHF, Fеlker et al. (2003) вивчали зв’язок між етіологією серцевої недостатності й ефективністю Мілринону [67]. Первинна кінцева точка становила 13,0 дня в пацієнтів з ішемічною етіологією ЗСН і 11,7 дня в пацієнтів із неішемічним походженням (р = 0,2). 60-денна смертність становила 11,6 % в ішемічній групі і 7,5 % — у неішемічній (р = 0,03). Після коригування за основними відмінностями спостерігався явний взаємозв’язок між етіологією серцевої недостатності та ефективністю Мілринону. У пацієнтів з ішемічною етіологією ЗСН, які приймали Мілринон, спостерігалася тенденція до гірших наслідків лікування, ніж у групі плацебо, за первинною кінцевою точкою (13,6 дня для Мілринону проти 12,4 дня для плацебо, р = 0,055) та комбінованою кінцевою точкою смерті або повторною госпіталізацією (42 проти 36 %, р = 0,01). Натомість при неішемічній етіології ЗСН при лікуванні Мілриноном спостерігалася тенденція до покращення первинної кінцевої точки (10,9 проти 12,6 дня в групі плацебо) та комбінованої кінцевої точки смерті або регоспіталізації (28 % проти 35 % в групі плацебо). Отже, на думку авторів, Мілринон може мати різноспрямований ефект залежно від етіології декомпенсованої ЗСН. Мілринон може завдавати шкоди при ішемічній ЗСН, але бути нейтральним або справляти позитивну дію при неішемічній кардіоміопатії.
Обмеженням даного дослідження є те, що в нього не були включені пацієнти, у яких використання інотропної терапії було обов’язковим (наприклад, низький серцевий викид із тканинною гіпоперфузією). Отже, у дослідженні могли бути представлені переважно пацієнти з декомпенсацією в основному внаслідок перевантаження рідиною, які в першу чергу потребують в/в діуретичної терапії і в яких інотропний ефект не є критично важливим. Також прискорена титрація дози пероральних інгібіторів АПФ могла призводити до частішої появи гіпотензивних епізодів у групі Мілринону. Також потрібно відзначити, що дане дослідження з огляду на досліджувані кінцеві точки мало дуже помітний фармакоекономічний характер, тобто дослідників переважно цікавили питання тривалості (і, відповідно, вартості лікування) госпіталізації, ніж параметри виживаності (для вивчення яких дослідження не мало відповідної потужності) і якості життя (які аналізувалися за недостатньо верифікованими шкалами). Також, можливо, період лікування Мілриноном для отримання повноцінної ефективності має бути більше ніж 48–72 години. Уроком цього дослідження має бути те, що Мілринон слід використовувати диференційовано, уважно відбираючи пацієнтів для лікування цим препаратом. Очевидно, що застосування інодилататору в пацієнтів, які потребують у першу чергу масивної діуретичної терапії, може призводити до негативних гіпотензивних епізодів. Разом із тим у пацієнтів з ознаками периферичної гіпоперфузії на фоні низького серцевого викиду, але без суттєвої затримки рідини за умови уважного гемодинамічного та антиаритмічного моніторингу застосування Мілринону як засобу, що дозволяє поліпшити функціональний стан пацієнтів, є достатньо виправданим. Це особливо важливо для пацієнтів із неішемічною етіологією ЗСН. Також слід уникати форсованої титрації інших препаратів базисної терапії ЗСН (інгібіторів АПФ) на фоні в/в застосування Мілринону.
Загалом можна зазначити, що позагемодинамічні ефекти Мілринону аналогічні таким в інших інотропних препаратів (добутамін, допамін, допексамін) та інгібіторів фосфодіестерази (амринон, емоксимон, тоборинон) [63].
Лікування гострої серцевої недостатності з діастолічною дисфункцією лівого шлуночка
Як уже зазначалося, попередні дослідження показали, що Мілринон має позитивну люзитропну дію [7], хоча цей ефект не було підтверджено іншими дослідниками в пацієнтів після АКШ [73, 78]. Albrecht et al. (2005) повідомили про перший позитивний досвід практичного лікування Мілриноном пацієнтів із декомпенсованою ЗСН на фоні діастолічної дисфункції [72].
Оцінка життєздатності міокарда
У деяких ситуаціях надзвичайно важливою є можливість передбачення ймовірного відновлення міокардіальної скоротливості в акінетичних/гіпокінетичних сегментах після проведення механічної реваскуляризації. Особливо важливо це для пацієнтів із вираженою лівошлуночковою систолічною дисфункцією, у яких розглядається можливість проведення перкутанних інтервенцій або АКШ. Dhar et al. (2001) провели дослідження в 20 пацієнтів з ІХС і фракцією викиду ЛШ ≤ 40 %, у яких спостерігалися ділянки життєздатного міокарда за результатами низькодозової добутамінової стрес-ехокардіографії або сцинтиграфії з талієм. Пацієнтам під час АКШ проводилася трансезофагеальна ехокардіографія з визначенням основних параметрів внутрішньосерцевої гемодинаміки, регіонарної скоротливості до введення Мілринону, через 10 хвилин і відразу після операції. ФВ до інфузії Мілринону становила 27 ± 5 %, після введення Мілринону — 35 ± 5 % (р < 0,001), після АКШ — 36 ± 6 % (р < 0,001). ФВ після АКШ вірогідно співвідносилася з ФВ після Мілринону (r = 0,65, р < 0,001). Покращення сегментарної скоротливості після АКШ спостерігалося у 84,8 % сегментів, у яких покращилася скоротливість після Мілринону, і тільки у 3,7 % сегментів не відреагували на Мілринон [58].
Застосування на фоні бета-блокаторів
Стандартом лікування пацієнтів із хронічною серцевою недостатністю є застосування бета-блокуючих препаратів. Хоча механізм дії Мілринону не залежить від стимуляції бета-адренорецепторів, але залишається відкритим питання, чи повною мірою зберігається інотропний та інші позитивні гемодинамічні ефекти Мілринону на фоні терапії бета-блокаторами. Travill et al. (1994) вивчали гемодинамічні ефекти Мілринону в 11 пацієнтів із стабільною ЗСН ФК II–III за NYHA, яким попередньо проводилася бета-блокада з використанням 50 мг метопрололу per os. Мілринон вводився внутрішньовенно в дозі 50 мкг/кг протягом 10 хв із подальшою інфузією 0,5 мкг/кг/хв протягом 50 хв. Пікова інотропна відповідь, що вимірювалася за максимальною швидкістю зростання лівошлуночкового тиску (dP/dt), розвивалася на 20-ту хвилину після початку лікування. Зберігалося зростання серцевого індексу та зниження ТЗЛК на статистично вірогідному рівні протягом періоду лікування [29]. У пацієнтів із декомпенсацією ЗСН на хронічній бета-блокаді для досягнення адекватного покращення серцевого індексу необхідно використовувати високі дози добутаміну (15–20 мкг/кг/хв), що рідко застосовуються на практиці й призводять до підвищення ЧСС, системного і легеневого артеріального тиску, тоді як використання Мілринону за таких умов гемодинамічно більш оптимальне [60].
Також інколи виникає і зворотна ситуація, коли вирішується питання про призначення і титрацію дози бета-блокатора в пацієнта, що перебуває на постійній або переривчастій інфузії Мілринону. Kumar et al. (2001) на прикладі 17 пацієнтів із ЗСН ФК III–IV за NYHA, які перебували на інтермітуючій інфузії Мілринону, показали можливість паралельного призначення й титрації карведилолу в 14 пацієнтів (93 %) протягом 8,1 ± 1,8 тижня. Цільова доза карведилолу (у даному дослідженні — 25 або 50 мг двічі на добу) була досягнута в 13 (87 %) пацієнтів. Побічні ефекти протягом періоду титрації дози карведилолу спостерігалися в 7 (47 %) пацієнтів. Після досягнення цільової дози карведилолу у 8 (53 %) пацієнтів інфузії Мілринону були припинені, а в решти частота інфузій суттєво зменшилася. У 10 (63 %) хворих спостерігалося покращення принаймні на один функціональний клас [59].
Порівняльні дослідження Мілринону
Звісно, дуже важливим етапом у розумінні ролі того чи іншого лікувального засобу є демонстрація його позитивних, а також негативних властивостей у безпосередньому порівнянні з існуючими аналогами. Оскільки Мілринон не є першим препаратом, який використовується для лікування декомпенсованої серцевої недостатності, то він був досліджений порівняно як з існуючими іАПФ (наприклад, каптоприлом), так і з інотропами, у першу чергу добутаміном.
Порівняння з каптоприлом. Le Jemtel et al. (1985) вивчали гемодинамічні зрушення при лікуванні Мілриноном і каптоприлом 11 пацієнтів із тяжкою ЗСН ФК III–IV за NYHA [8]. При лікуванні Мілриноном спостерігалося суттєвіше зростання індексу ударного об’єму (28 ± 7 мл/м2 у групі Мілринону порівняно з 24 ± 7 мл/м2 у групі каптоприлу, р < 0,05), тоді як тиск заклинювання легеневих капілярів зменшувався однаково. Середній системний артеріальний тиск вірогідно зменшився в групі каптоприлу (з 84 ± 10 мм рт.ст. до 73 ± 11 мм рт.ст., р < 0,05), але не змінився в групі Мілринону. Жоден препарат не обумовив вірогідних змін частоти серцевих скорочень. Уміст кисню в стегновій вені підвищився при лікуванні Мілриноном (з 7,9 ± 2,6 мл/100 мл до 9,8 ± 3,0 мл/100 мл, р < 0,05), але не змінився при застосуванні каптоприлу. Також у 7 пацієнтів проводилося введення Мілринону на фоні піку дії каптоприлу, і це призводило до подальшого збільшення серцевого викиду без вірогідного зменшення артеріального тиску й збільшення ЧСС. Хоча рівень ниркового кровообігу не збільшився при одночасному застосуванні Мілринону й каптоприлу, уміст кисню в стегновій вені був вірогідно більшим. Отже, використання Мілринону на фоні лікування іАПФ призводить до розвитку додаткових позитивних гемодинамічних змін, препарат добре переноситься пацієнтами із найтяжчими формами ЗСН.
Порівняння з добутаміном. Mager et al. (1991) проводили порівняння в/в інфузій добутаміну й Мілринону, що призначалися у вигляді послідовних 24-годинних інфузій, у 20 пацієнтів із ЗСН ФК III–IV за NYHA [22]. Добутамін призначався в максимальній дозі 15 мкг/кг/хв. Інфузію добутаміну довелося припинити або зменшити швидкість у зв’язку з ЧСС понад 140 уд/хв у 3 пацієнтів, ще у 2 пацієнтів — у зв’язку з недостатнім гемодинамічним ефектом протягом 3 год інфузії. Усі 20 пацієнтів добре переносили в/в інфузію Мілринону. Порівняння гемодинамічних параметрів проводилося в 15 пацієнтів, які пройшли повний курс лікування обома препаратами. Добутамін вірогідно збільшував ЧСС, тоді як Мілринон не справляв такої дії. Ударний об’єм протягом першої години в/в інфузії добутаміну збільшився з 19,3 до 28,9 мл/м2 (на 49,6 %), а потім поступово знижувався до 25,2 мл/м2 протягом наступних 12 годин; під час в/в інфузії Мілринону ударний об’єм виріс з 18,8 мл/м2 до 31,2 мл/м2 (на 66 %) і залишався на такому ж рівні до завершення інфузії (30,2 мл/м2). ТЗЛК відразу після початку інфузії Мілринону знизився з 26,5 до 16,2 мм рт.ст. через 30 хвилин і залишився на рівні 20,1 мм рт.ст. через 24 години. Під час інфузії добутаміну ТЗЛК знизився з деякою затримкою (через 6 годин) з 27,8 до 19,0 мм рт.ст. і поступово збільшився до 22,7 мм рт.ст. через 24 години.
Feneck et al. (2001) провели порівняння гемодинамічного впливу, ефективності й безпечності в/в Мілринону (50 мкг/кг протягом 10 хвилин плюс інфузія 0,5 мкг/кг/хв) і в/в добутаміну (10–20 мкг/кг/хв) у пацієнтів із низьким серцевим викидом після кардіохірургічних утручань [57]. Дослідження мало рандомізований відкритий багатоцентровий дизайн. Усього було включено 120 пацієнтів (по 60 у кожній групі лікування). Аналізувалися показники гемодинаміки на початку лікування й відсоток їх зміни протягом 4 годин інфузії препарату. Також реєструвалася частота побічних ефектів. В обох групах до лікування спостерігалися низькі показники серцевого індексу (Мілринон — 1,6 ± 0,03 л/хв/м2; добутамін — 1,7 ± 0,03 л/хв/м2) у поєднанні з адекватним середнім ТЗЛК (Мілринон — 13,7 ± 1,3 мм рт.ст.; добутамін — 12,7 ± 1,9 мм рт.ст.). У групі Мілринону були вірогідно вищі параметри системного артеріального тиску й системного судинного опору, ніж у групі добутаміну, інші показники гемодинаміки були ідентичними. Протягом дослідження гемодинамічні зміни були такими: у групі добутаміну спостерігалося більш суттєве підвищення серцевого індексу (через 1 год лікування на 55 %, у групі Мілринону — на 36 %, р < 0,001), ЧСС (через 1 год у групі добутаміну — на 35 %, у групі Мілринону — на 10 %, р < 0,001), артеріального тиску (середній АТ через 1 год у групі добутаміну — на 31 %, у групі Мілринону — на 7 %, р < 0,001) і лівошлуночкового індексу ударної роботи (через 1 год у групі добутаміну — на 75 %, у групі Мілринону — 45 %, р < 0,001). У групі Мілринону спостерігалося більш суттєве зниження середнього ТЗЛК (через 1 год у групі добутаміну — на 3 %, у групі Мілринону — на 14 %, р < 0,05). Щодо побічних ефектів, то лікування добутаміном частіше супроводжувалося розвитком гіпертензії (у групі добутаміну — 40 %, у групі Мілринону — 13 %, р < 0,02) і розвитком фібриляції передсердь (у групі добутаміну — 18 %, у групі Мілринону — 5 %, р < 0,04). Застосування Мілринону супроводжувалося більшою частотою синусової брадикардії (у групі добутаміну — 2 %, у групі Мілринону — 13 %, р < 0,03). Отже, Мілринон і добутамін є порівнянними препаратами для фармакологічного лікування станів низького викиду після серцево-легеневого шунтування.
Lуpez-Candales et al. (2002) провели порівняння інтермітуючих режимів інфузійної терапії з використанням добутаміну, Мілринону, плацебо в 29 пацієнтів із тяжкою ЗСН (середній вік — 66 ± 13 років, середня ФВЛШ — 18 ± 9 %, функціональний клас за NYHA — 3,6 ± 0,5). У всіх 29 пацієнтів удалося досягти стану, при якому їм більше не була потрібна інфузія інотропів. Для цього пацієнти з групи Мілринону потребували найменше лікувальних сесій — 19 ± 8, тоді як у групі добутаміна — 31 ± 12, плацебо — 33 ± 10, р < 0,02. Тільки 10 % пацієнтів із групи Мілринону потребували переведення на інший тип лікування, тоді як у групі добутаміну — 27 %, плацебо — 75 %. Серед пацієнтів, які отримували інотропи, спостерігалося вірогідно більше покращення параметрів якості життя, 6-хвилинного тесту ходьби [69].
Порівняння з неcиритидом. Неcиритид є фармакологічним аналогом мозкового передсердного натрійуретичного пептиду. Brackbill et al. (2007) провели порівняння несиритиду й Мілринону в 40 гемодинамічно стабільних пацієнтів із ФВЛШ < 35 %, які проходили планове аортокоронарне шунтування. Дослідження мало рандомізований відкритий проспективний дизайн. Пацієнти отримували болюс несиритиду або Мілринону з подальшою 24-годинною інфузією препарату. Метою дослідження було встановити можливість профілактики розвитку постопераційної серцевої недостатності. Автори показали, що середній час перебування пацієнтів у відділенні інтенсивної терапії після завершення операції в групі несиритиду становив 50,6 ± 46,8 години, у групі Мілринону — 44,1 ± 23,5 години (р = 0,578). Частота розвитку постопераційної серцевої недостатності, повторних госпіталізацій протягом 30 днів спостереження була однаковою в обох групах лікування [77].
Порівняння з левосименданом. Al-Shawaf et al. (2006) показали, що левосимендан і Мілринон мають практично ідентичну гемодинамічну ефективність при лікуванні діабетиків із низьким серцевим викидом після планового аортокоронарного шунтування [75].
Безпечність Мілринону
Питання безпечності лікування є одним з наріжних каменів у сучасній медицині. Особливо це стосується препаратів, які забезпечують переважно симптоматичне покращення без істотного впливу на показники загального чи кардіоваскулярного виживання (таких як добутамін, левосимендан, несиритид, Мілринон тощо). Тому в цьому контексті є досить важливими результати дослідження Mehra et al. (1997), які показали, що використання в/в інфузії Мілринону протягом 8 тижнів у пацієнтів із тяжкою ЗСН, яка потребує безперервної інотропної підтримки (наприклад, в очікуванні трансплантата серця), є безпечним, препарат добре переноситься, а терапія забезпечує стійкі гемодинамічні ефекти [39]. Milfred-LaForest et al. (1999) використовували довготривалі інфузії Мілринону в 63 пацієнтів із ЗСН ФК III–IV за NYHA. Середня доза Мілринону становила 0,43 ± 0,10 мкг/кг/хв, середня тривалість лікування — 12 ± 15 діб (від 1 доби до 70 діб). Тільки в 10 % пацієнтів спостерігалася симптомна шлуночкова тахікардія, а в 2 пацієнтів інфузію довелося припинити через виражену гіпотензію [47].
Одним з основних лімітуючих факторів використання інфузійного Мілринону є розвиток гіпотензії. Дане ускладнення може коригуватися за рахунок додаткового введення вазопресорів, наприклад низьких доз вазопресину [50]. Іншим способом профілактики гіпотензії є відмова від початкового болюсного введення. Baruch et al. (2001) у пацієнтів із декомпенсованою ЗСН вивчали гемодинамічні ефекти двох режимів уведення Мілринону — з початковим болюсним уведенням 50 мкг/кг (n = 10) і без нього (n = 9). Усі пацієнти надалі отримували Мілринон у підтримуючій дозі 0,5 мкг/кг/хв. У групі з болюсним уведенням Мілринону типові гемодинамічні ефекти спостерігалися відразу після болюсу, тоді як у групі без болюсного введення суттєві зміни гемодинаміки реєструвалися через 30 хвилин після початку інфузії. В обох групах відзначалося однакове зниження ТЗЛК на 2-й годині лікування, підвищення серцевого індексу, однакова концентрація препарату у крові — на 3-й годині лікування. У групі болюсного введення Мілринону в 1 пацієнта виникла суттєва гіпотензія, і в нього було припинене подальше лікування з використанням в/в інфузії. Отже, за результатами цього маленького дослідження можна сказати, що в/в введення Мілринону без початкового болюсу є достатньо ефективним та безпечним методом лікування [54].
Мілринон у контексті Міжнародних рекомендацій з лікування гострої серцевої недостатності
Унаслідок постарішання населення в багатьох країнах Європи та збільшення виживаності після перенесеного гострого інфаркту міокарда швидко зростають кількість пацієнтів із ЗСН і, відповідно, число госпіталізацій з приводу декомпенсації ЗСН. Серцева недостатність є провідною причиною госпіталізацій у системі Medicare у США. У Європі спостерігається така ж тенденція. Ішемічна хвороба серця є основною причиною виникнення ЗСН у 60–70 % пацієнтів, особливо літнього віку. У молодших пацієнтів гостра серцева недостатність часто розвивається внаслідок дилатаційної кардіоміопатії, аритмій, уродженних, клапанних захворювань серця, міокардитів. Зважаючи на важливість проблеми гострої серцевої недостатності в сучасній кардіології Європейське товариство кардіологів 2005 року опублікувало керівництво з діагностики та лікування гострої серцевої недостатності. У даному керівництві представлені основні рекомендації з використання як інотропних, так і вазодилатуючих препаратів на етапі гострої декомпенсації ЗСН [35]. Цього року дане керівництво було оновлене [80].
Згідно з цим документом, Мілринон рекомендується використовувати в дозі 25–75 мкг/кг в/в болюсно протягом 10 хвилин, а потім переходити на підтримуючу в/в інфузію зі швидкістю 0,375–0,75 мкг/кг/хв. У пацієнтів із дуже низьким АТ можна розпочинати лікування без первинного в/в болюсного введення. Мілринон, як й інші інотропи, рекомендується до використання в пацієнтів із гострою серцевою недостатністю при стані низького серцевого викиду, за наявності ознак гіпоперфузії або застою, незважаючи на використання вазодилататорів та/або діуретиків для покращення симптоматики (рис. 3). Серед ознак гіпоперфузії — холодна липка шкіра в пацієнтів із вазоконстрикцією й ацидозом, нирковою, печінковою дисфункцією, дихальною недостатністю. Лікування призначається тільки при дилатованих, гіпокінетичних шлуночках. За потреби інотропи призначаються якомога раніше й відміняються якомога швидше після відновлення адекватної органної перфузії та/або зменшення ознак застою (клас рекомендацій ІІа, рівень доказовості В). Хоча інотропи можуть значно покращити гемодинамічний і клінічний статус пацієнта, але вони також можуть прискорити розвиток патофізіологічних механізмів, що спричиняють подальше міокардіальне ушкодження та підвищують коротко- і довготривалу смертність. Інгібітори фосфодіестерази (Мілринон, еноксимон) слід з обережністю призначати в пацієнтів з ІХС (клас рекомендацій ІІb, рівень доказовості В), оскільки в них вони можуть підвищувати середньотривалу смертність.
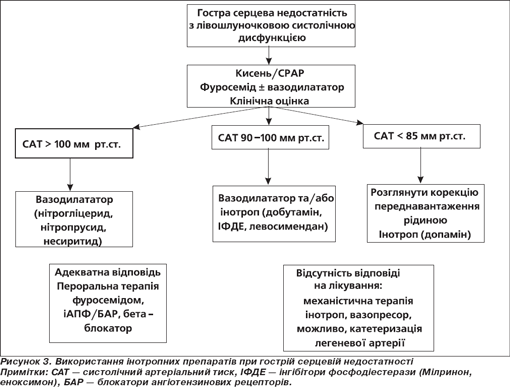
В інших міжнародних широко цитованих рекомендаціях Heart Failure Society of America щодо лікування серцевої недостатності відзначається, що внітрішньовенні інотропи (добутамін або Мілринон) можуть використовуватися для полегшення симптоматики і покращення функції органів-мішеней у пацієнтів із декомпенсованою ЗСН, що характеризується дилатацією, зменшеною ФВ лівого шлуночка та зниженою периферичною перфузією та/або дисфункцією органів-мішеней (синдром низького викиду), особливо якщо в цих пацієнтів спостерігається зменшення систолічного артеріального тиску (< 90 мм рт.ст.), наявна симптоматика гіпотензії, незважаючи на адекватний тиск наповнення, або пацієнти не відповідають чи не переносять внутрішньовенні вазодилататори. Ці препарати можуть використовуватися також у пацієнтів з ознаками перевантаження рідиною, якщо вони недостатньо добре відповідають на інфузію діуретиків або в них спостерігається порушення ниркової функції. В інших ситуаціях при декомпенсації ЗСН у першу чергу необхідно розглядати застосування вазодилататорів замість внутрішньовенних інотропів. Внутрішньовенні інотропи не рекомендуються, якщо не встановлено підвищення тиску наповнення в лівих камерах серця за допомогою безпосереднього вимірювання або чітких клінічних ознак. Призначення внутрішньовенних інотропів (добутаміну чи Мілринону) за умов гострої декомпенсованої ЗСН має супроводжуватися постійним або частим моніторуванням артеріального тиску й серцевого ритму. При розвитку симптомної гіпотензії або загрожуючої тахіаритмії дані препарати слід відмінити або знизити їх дозу [79].
Сфери застосування в сучасній медицині. Отже, основними напрямками використання Мілринону, інодилататора, інгібітора фосфодіестерази, що підвищує скоротність міокарда та спричиняє збалансовану артеріальну й венозну дилатацію, є такі:
— лікування гострої серцевої недостатності або гострої декомпенсації хронічної СН за умов, зазначених у рекомендаціях провідних кардіологічних товариств;
— Мілринон може застосовуватися як місток до трансплантації серця в пацієнтів із неішемічною (наприклад, вірусною) кардіоміопатією, що дозволяє зменшити рівень використання традиційної інотропної підтримки (інтрааортальна балонна контрпульсація, добутамін) [20, 52];
— лікування станів низького серцевого викиду після кардіохірургічних утручань [24–26];
— лікування і профілактика станів низького серцевого викиду в педіатричній кардіохірургії;
— лікування негіпердинамічного септичного шоку в дітей, як у монотерапії, так і в комбінації з катехоламінами [37].
1. Baim D.S., McDowell A.V., Cherniles J., Monrad E.S., Parker J.A., Edelson J., Braunwald E., Grossman W. Evaluation of a new bipyridine inotropic agent — milrinone — in patients with severe congestive heart failure // N Engl J Med 1983 Sep 29; 309(13): 748-56.
2. Stroshane R.M., Koss R.F., Biddlecome C.E., Luczkowec C., Edelson J. Oral and intravenous pharmacokinetics of milrinone in human volunteers // J Pharm Sci 1984 Oct; 73(10): 1438-41.
3. Alousi A.A., Stankus G.P., Stuart J.C., Walton L.H. Characterization of the cardiotonic effects of milrinone, a new and potent cardiac bipyridine, on isolated tissues from several animal species // J Cardiovasc Pharm 1983; 5: 804.
4. Alousi A.A., Canter J.M., Montenaro M.J., Fort D.J., Ferrari R.A. Cardiotonic activity of milrinone, a new and potent cardiac bipyridine, on the normal and failing heart of experimental animals // J Cardiovasc Pharm 1983; 5: 792.
5. Maskin C.S., Sinoway L., Chadwick B., Sonnenblick E.H., LeJemtel T.H. Sustained hemodynamic and clinical benefits of a new cardiotonic agent, WIN 47203, in patients with severe congestive heart failure // Circulation 1983; 67: 1065.
6. Sinoway L.S., Maskin C.S., Chadwick B., Forman R., Sonnenblick E.H., LeJemtel T.H. Long term therapy with a new cardiotonic agent, WIN 47203: drug-dependent improvement in cardiac performance and progression of the underlying disease // J Am Coll Cardiol 1983; 2: 327.
7. Monrad E.S., McKay R.G., Baim D.S., Colucci W.S., Fifer M.A., Heller G.V., Royal H.D., Grossman W. Improvement in indexes of diastolic performance in patients with congestive heart failure treated with milrinone // Circulation 1984 Dec; 70(6): 1030-7.
8. LeJemtel T.H., Maskin C.S., Mancini D., Sinoway L., Feld H., Chadwick B. Systemic and regional hemodynamic effects of captopril and milrinone administered alone and concomitantly in patients with heart failure // Circulation 1985 Aug; 72(2): 364-9.
9. Benotti J.R., Lesko L.J., McCue J.E., Alpert J.S. Pharmacokinetics and pharmacodynamics of milrinone in chronic congestive heart failure // Am J Cardiol 1985 Oct 1; 56(10): 685-9.
10. Edelson J., Stroshane R., Benziger D.P., Cody R., Benotti J., Hood W.B. Jr, Chatterjee K., Luczkowec C., Krebs C., Schwartz R. Pharmacokinetics of the bipyridines amrinone and milrinone // Circulation 1986 Mar; 73 (3 Pt 2): III145-52.
11. Anderson J.L., Askins J.C., Gilbert E.M., Menlove R.L., Lutz J.R. Occurrence of ventricular arrhythmias in patients receiving acute and chronic infusions of milrinone // Am Heart J 1986 Mar; 111(3): 466-74.
12. Brown L., Nabauer M., Erdmann E. Additive positive inotropic effects of milrinone, ouabain and calcium in diseased human ventricular myocardium // Klin Wochenschr 1986 Aug 1; 64(15): 708-12.
13. Anderson J.L., Baim D.S., Fein S.A., Goldstein R.A., LeJemtel T.H., Likoff M.J. Efficacy and safety of sustained (48 hour) intravenous infusions of milrinone in patients with severe congestive heart failure: a multicenter study // J Am Coll Cardiol 1987 Apr; 9(4): 711-22.
14. Ludmer P.L., Baim D.S., Antman E.M., Gauthier D.F., Rocco M.B., Friedman P.L., Colucci W.S. Effects of milrinone on complex ventricular arrhythmias in congestive heart failure secondary to ischemic or idiopathic dilated cardiomyopathy // Am J Cardiol 1987 Jun 1; 59(15): 1351-5.
15. Colucci W.S., Denniss A.R., Leatherman G.F., Quigg R.J., Ludmer P.L., Marsh J.D., Gauthier D.F. Intracoronary infusion of dobutamine to patients with and without severe congestive heart failure. Dose-response relationships, correlation with circulating catecholamines, and effect of phosphodiesterase inhibition // J Clin Invest 1988 Apr; 81(4): 1103-10.
16. Ito M., Tanaka T., Saitoh M., Masuoka H., Nakano T., Hidaka H. Selective inhibition of cyclic AMP phosphodiesterase from various human tissues by milrinone, a potent cardiac bipyridine // Biochem Pharmacol 1988 May 15; 37(10): 2041-4.
17. Bohm M., Diet F., Kemkes B., Erdmann E. Enhancement of the effectiveness of milrinone to increase force of contraction by stimulation of cardiac beta-adrenoceptors in the failing human heart // Klin Wochenschr 1988 Oct 3; 66(19): 957-62.
18. Lindgren S.H., Andersson T.L., Vinge E., Andersson K.E. Effects of isozyme-selective phosphodiesterase inhibitors on rat aorta and human platelets: smooth muscle tone, platelet aggregation and cAMP levels // Acta Physiol Scand 1990 Oct; 140(2): 209-19.
19. Pflugfelder P.W., O’Neill B.J., Ogilvie R.I., Beanlands D.S., Tanser P.H., Tihal H., Mizgala H.F., Fitchett D.H., Kostuk W.J. A Canadian multicentre study of a 48 h infusion of milrinone in patients with severe heart failure // Can J Cardiol 1991 Jan — Feb; (1): 5-10.
20. Watson D.M., Sherry K.M., Weston G.A. Milrinone, a bridge to heart transplantation // Anaesthesia 1991 Apr; 46(4): 285-7.
21. Lindgren S., Andersson K.E. Effects of selective phosphodiesterase inhibitors on isolated coronary, lung and renal arteries from man and rat // Acta Physiol Scand 1991 May; 142(1): 77-82.
22. Mager G., Klocke R.K., Kux A., Hцpp H.W., Hilger H.H. Phosphodiesterase III inhibition or adrenoreceptor stimulation: milrinone as an alternative to dobutamine in the treatment of severe heart failure // Am Heart J 1991 Jun; 121(6 Pt 2): 1974-83.
23. Klocke R.K., Mager G., Kux A., Hцpp H.W., Hilger H.H. Effects of a twenty-four-hour milrinone infusion in patients with severe heart failure and cardiogenic shock as a function of the hemodynamic initial condition // Am Heart J 1991 Jun; 121(6 Pt 2): 1965-73.
24. Feneck R.O. Effects of variable dose milrinone in patients with low cardiac output after cardiac surgery. European Multicenter Trial Group // Am Heart J 1991 Jun; 121(6 Pt 2): 1995-9.
25. Wright E.M., Sherry K.M. Clinical and haemodynamic effects of milrinone in the treatment of low cardiac output after cardiac surgery // Br J Anaesth 1991 Nov; 67(5): 585-90.
26. Lanсon J.P., Caillard B., Obadia J.F., Pillet M., Leblanc-Beaufils C., Le Bloch Y. Hemodynamic effects of milrinone in the treatment of cardiac insufficiency after heart surgery with extracorporeal circulation // Arch Mal Coeur Vaiss 1991 Nov; 84(11): 1575-9.
27. Packer M., Carver J.R., Rodeheffer R.J., Ivanhoe R.J., DiBianco R., Zeldis S.M., Hendrix G.H., Bommer W.J., Elkayam U., Kukin M.L. et al. Effect of oral milrinone on mortality in severe chronic heart failure. The PROMISE Study Research Group // N Engl J Med 1991 Nov 21; 325(21): 1468-75.
28. Meissner A., Herrmann G., Gerdesmeyer L., Simon R. Additive effects of milrinone and dobutamine in severe heart failure // Z Kardiol 1992 May; 81(5): 266-71.
29. Travill C.M., Pugh S., Noble M.I. The inotropic and hemodynamic effects of intravenous milrinone when reflex adrenergic stimulation is suppressed by beta-adrenergic blockade // Clin Ther 1994 Sep — Oct; 16(5): 783-92.
30. Dominguez de Rozas J.M., Guindo Soldevila J., Rodriguez Font E., Martinez Vilchez R. The hemodynamic effects of the combination of milrinone in heart failure refractory to treatment with dopamine, dobutamine and/or nitroprusside // Rev Esp Cardiol 1994 Oct; 47(10): 682-6.
31. De Hert S.G., Moens M.M., Jorens P.G., Delrue G.L., DePaep R.J., Vermeyen K.M. Comparison of two different loading doses of milrinone for weaning from cardiopulmonary bypass // J Cardiothorac Vasc Anesth 1995 Jun; 9(3): 264-71.
32. Kikura M., Lee M.K., Safon R.A., Bailey J.M., Levy J.H. The effects of milrinone on platelets in patients undergoing cardiac surgery // Anesth. Analg 1995 Jul; 81(1): 44-8.
33. Butterworth J.F. 4th, Hines R.L., Royster R.L., James R.L. A pharmacokinetic and pharmacodynamic evaluation of milrinone in adults undergoing cardiac surgery // Anesth Analg 1995 Oct; 81(4): 783-92.
34. Chang A.C., Atz A.M., Wernovsky G., Burke R.P., Wessel D.L. Milrinone: systemic and pulmonary hemodynamic effects in neonates after cardiac surgery // Crit Care Med 1995 Nov; 23(11): 1907-14.
35. Guidelines on the diagnosis and treatment of acute heart failure // EHJ, doi:10.1093/eurheartj/ehi117
36. Karlsberg R.P., DeWood M.A., DeMaria A.N., Berk M.R., Lasher K.P. Comparative efficacy of short-term intravenous infusions of milrinone and dobutamine in acute congestive heart failure following acute myocardial infarction. Milrinone-Dobutamine Study Group // Clin Cardiol 1996 Jan; 19(1): 21-30.
37. Barton P., Garcia J., Kouatli A., Kitchen L., Zorka A., Lindsay C., Lawless S., Giroir B. Hemodynamic effects of i.v. milrinone lactate in pediatric patients with septic shock. A prospective, double-blinded, randomized, placebo-controlled, interventional study // Chest 1996 May; 109(5): 1302-12.
38. Doolan L.A., Jones E.F., Kalman J., Buxton B.F., Tonkin A.M. A placebo-controlled trial verifying the efficacy of milrinone in weaning high-risk patients from cardiopulmonary bypass // J Cardiothorac Vasc Anesth 1997 Feb; 11(1): 37-41.
39. Mehra M.R., Ventura H.O., Kapoor C., Stapleton D.D., Zimmerman D., Smart F.W. Safety and clinical utility of long-term intravenous milrinone in advanced heart failure // Am J Cardiol 1997 Jul 1; 80(1): 61-4.
40. Kikura M., Levy J.H., Michelsen L.G., Shanewise J.S., Bailey J.M., Sadel S.M., Szlam F. The effect of milrinone on hemodynamics and left ventricular function after emergence from cardiopulmonary bypass // Anesth Analg 1997 Jul; 85(1): 16-22.
41. Nemoto S., Sakai A., Nakamura K., Miyoshi Y., Yasuhara K. Effects of milrinone in patients undergoing cardiac surgery // Kyobu Geka 1997 Oct; 50(11): 935-8.
42. Ramamoorthy C., Anderson G.D., Williams G.D., Lynn A.M. Pharmacokinetics and side effects of milrinone in infants and children after open heart surgery // Anesth Analg 1998 Feb; 86(2): 283-9.
43. Alhashemi J.A., Hooper J. Treatment of milrinone-associated tachycardia with beta-blockers // Can J Anaesth 1998 Jan; 45(1): 67-70.
44. Okabe H., Kaneko Y., Nagata N., Kobayashi J., Kanemoto S., Ka H., Fuijmoto J., Fuijwara T. Hemodynamic effects of amrinone or milrinone in infant after right heart bypass operation // Kyobu Geka 1998 Jul; 51(7): 543-8.
45. Orime Y., Shiono M., Hata H., Yagi S., Tsukamoto S., Kimura S., Ohmiya S., Sezai A., Yamada H., Obana M., Sezai Y. Effects of concomitant usage of milrinone and catecholamine for weaning from cardiopulmonary bypass // J Thorac Cardiovasc Surg 1998 Sep; 46(9): 803-9.
46. Lobato E.B., Florete O. Jr, Bingham H.L. A single dose of milrinone facilitates separation from cardiopulmonary bypass in patients with pre-existing left ventricular dysfunction // Br J Anaesth 1998 Nov; 81(5): 782-4.
47. Milfred-LaForest S.K., Shubert J., Mendoza B., Flores I., Eisen H.J., Piсa I.L. Tolerability of extended duration intravenous milrinone in patients hospitalized for advanced heart failure and the usefulness of uptitration of oral angiotensin-converting enzyme inhibitors // Am J Cardiol 1999 Oct 15; 84(8): 894-9.
48. Hayashida N., Tomoeda H., Oda T., Tayama E., Chihara S., Kawara T., Aoyagi S. Inhibitory effect of milrinone on cytokine production after cardiopulmonary bypass // Ann Thorac Surg 1999 Nov; 68(5): 1661-7.
49. Lobato E.B., Urdaneta F., Martin T.D., Gravenstein N. Effects of milrinone versus epinephrine on grafted internal mammary artery flow after cardiopulmonary bypass // J Cardiothorac Vasc Anesth 2000 Feb; 14(1): 9-11.
50. Gold J., Cullinane S., Chen J., Seo S., Oz M.C., Oliver J.A., Landry D.W. Vasopressin in the treatment of milrinone-induced hypotension in severe heart failure // Am J Cardiol 2000 Feb 15; 85(4): 506-8, A11.
51. Chu C.C., Lin S.M., New S.H., Ting C.K., Chow L.H., Tsou M.Y., Tsai S.K., Lee T.Y. Effect of milrinone on postbypass pulmonary hypertension in children after tetralogy of Fallot repair // Zhonghua Yi Xue Za Zhi (Taipei) 2000 Apr; 63(4): 294-300.
52. Koyanagi T., Kyo S., Ouchi H., Asano H., Yokote Y., Omoto R. Clinical experience of milrinone as a pharmacological bridge to heart transplantation // Jpn J Thorac Cardiovasc Surg 2000 Jul; 48(7): 460-3.
53. Yamada T., Takeda J., Katori N., Tsuzaki K., Ochiai R. Hemodynamic effects of milrinone during weaning from cardiopulmonary bypass: comparison of patients with a low and high prebypass cardiac index // J Cardiothorac Vasc Anesth 2000 Aug; 14(4): 367-73.
54. Baruch L., Patacsil P., Hameed A., Pina I., Loh E. Pharmacodynamic effects of milrinone with and without a bolus loading infusion // Am Heart J 2001 Feb; 141(2): 266-73.
55. Gottschling-Zeller H., Aprath I., Skurk T., Hauner H. Beta-Adrenoceptor agonists and other cAMP elevating agents suppress PAI-1 production of human adipocytes in primary culture // Horm Metab Res 2000 Nov — Dec; 32(11-12): 509-14.
56. Yamaura K., Okamoto H., Akiyoshi K., Irita K., Taniyama T., Takahashi S. Effect of low-dose milrinone on gastric intramucosal pH and systemic inflammation after hypothermic cardiopulmonary bypass // J Cardiothorac Vasc Anesth 2001 Apr; 15(2): 197-203.
57. Feneck R.O., Sherry K.M., Withington P.S., Oduro-Dominah A.; European Milrinone Multicenter Trial Group. Comparison of the hemodynamic effects of milrinone with dobutamine in patients after cardiac surgery // J Cardiothorac Vasc Anesth 2001 Jun; 15(3): 306-15.
58. Dhar S.C., Birnbaum Y., Hayes S., Naqvi T., Cercek B., Blanche C., Friedman A., Trento A., Siegel R.J. Milrinone echocardiographic viability test: a pilot study // J Am Soc Echocardiogr 2001 Jul; 14(7): 668-75.
59. Kumar A., Choudhary G., Antonio C., Just V., Jain A., Heaney L., Papp M.A. Carvedilol titration in patients with congestive heart failure receiving inotropic therapy // Am Heart J 2001 Sep; 142(3): 512-5.
60. Lowes B.D., Tsvetkova T., Eichhorn E.J., Gilbert E.M., Bristow M.R. Milrinone versus dobutamine in heart failure subjects treated chronically with carvedilol // Int J Cardiol 2001 Dec; 81(2–3): 141-9.
61. Kikura M., Sato S. The efficacy of preemptive Milrinone or Amrinone therapy in patients undergoing coronary artery bypass grafting // Anesth Analg 2002 Jan; 94(1): 22-30.
62. Sulek C.A., Blas M.L., Lobato E.B. Milrinone increases middle cerebral artery blood flow velocity after cardiopulmonary bypass // J Cardiothorac Vasc Anesth 2002 Feb; 16(1): 64-9.
63. Thackray S., Easthaugh J., Freemantle N., Cleland J.G. The effectiveness and relative effectiveness of intravenous inotropic drugs acting through the adrenergic pathway in patients with heart failure-a meta-regression analysis // Eur J Heart Fail 2002 Aug; 4(4): 515-29.
64. Hiramatsu N., Kageyama K. Anti-thrombotic effect of milrinone is caused by inhibition of calcium release from the dense tubular system in human platelets // Acta Anaesthesiol Scand 2003 Jan; 47(1): 53-7.
65. Zeng H., Wen S., Huang D., Liu X., Fang Y. Response to milrinone treatment in patients with chronic congestive heart failure // Hua Xi Yi Ke Da Xue Xue Bao 2000 Jun; 31(2): 246-7, 259.
66. Hoffman T.M., Wernovsky G., Atz A.M., Kulik T.J., Nelson D.P., Chang A.C., Bailey J.M., Akbary A., Kocsis J.F., Kaczmarek R., Spray T.L., Wessel D.L. Efficacy and safety of milrinone in preventing low cardiac output syndrome in infants and children after corrective surgery for congenital heart disease // Circulation 2003 Feb 25; 107(7): 996-1002.
67. Felker G.M., Benza R.L., Chandler A.B., Leimberger J.D., Cuffe M.S., Califf R.M., Gheorghiade M., O’Connor C.M.; OPTIME-CHF Investigators. Heart failure etiology and response to milrinone in decompensated heart failure: results from the OPTIME-CHF study // J Am Coll Cardiol 2003 Mar 19; 41(6): 997-1003.
68. Zewail A.M., Nawar M., Vrtovec B., Eastwood C., Kar M.N., Delgado R.M. 3rd. Intravenous milrinone in treatment of advanced congestive heart failure // Tex Heart Inst J 2003; 30(2): 109-13.
69. Lоpez-Candales A., Vora T., Gibbons W., Carron C., Simmons P., Schwartz J. Symptomatic improvement in patients treated with intermittent infusion of inotropes: a double-blind placebo controled pilot study // J Med 2002; 33(1–4): 129-46.
70. Kim J.H., Ham B.M., Kim Y.L., Bahk J.H., Ryu H.G., Jeon Y.S., Kim K.B. Prophylactic milrinone during OPCAB of posterior vessels: implication in angina patients taking beta-blockers // Eur J Cardiothorac Surg 2003 Nov; 24(5): 770-6.
71. Khazin V., Kaufman Y., Zabeeda D., Medalion B., Sasson L., Schachner A., Ezri T. Milrinone and nitric oxide: combined effect on pulmonary artery pressures after cardiopulmonary bypass in children // J Cardiothorac Vasc Anesth 2004 Apr; 18(2): 156-9.
72. Albrecht C.A., Giesler G.M., Kar B., Hariharan R., Delgado R.M. 3rd. Intravenous milrinone infusion improves congestive heart failure caused by diastolic dysfunction: a brief case series // Tex Heart Inst J 2005; 32(2): 220-3.
73. Lobato E.B., Willert J.L., Looke T.D., Thomas J., Urdaneta F. Effects of milrinone versus epinephrine on left ventricular relaxation after cardiopulmonary bypass following myocardial revascularization: assessment by color m-mode and tissue Doppler // J Cardiothorac Vasc Anesth 2005 Jun; 19(3): 334-9.
74. Bassler D., Choong K., McNamara P., Kirpalani H. Neonatal persistent pulmonary hypertension treated with milrinone: four case reports // Biol Neonate 2006; 89(1): 1-5. Epub 2005 Sep 8.
75. Al-Shawaf E., Ayed A., Vislocky I., Radomir B., Dehrab N., Tarazi R. Levosimendan or milrinone in the type 2 diabetic patient with low ejection fraction undergoing elective coronary artery surgery // J Cardiothorac Vasc Anesth 2006 Jun; 20(3): 353-7.
76. Bhat G. Predictors of clinical outcome in advanced heart failure patients on continuous intravenous milrinone therapy // ASAIO J 2006 Nov–Dec; 52(6): 677-81.
77. Brackbill M.L., Stam M.D., Schuller-Williams R.V., Dhavle A.A. Perioperative nesiritide versus milrinone in high-risk coronary artery bypass graft patients // Ann Pharmacother 2007 Mar; 41(3): 427-32.
78. Couture P., Denault A.Y., Pellerin M., Tardif J.C. Milrinone enhances systolic, but not diastolic function during coronary artery bypass grafting surgery // Can J Anaesth 2007 Jul; 54(7): 509-22.
79. Adams K.F., Lindenfeld J., Arnold J.M.O., Baker D.W., Barnard D.H., Baughman K.L., Boehmer J.P., Deedwania P., Dunbar S.B., Elkayam U. et al., for the Heart Failure Society of America. HFSA 2006 Comprehensive Heart Failure Practice Guideline // J Cardiac Failure 2006; 12: e1-e122
80. ESC guidelines on the diagnosis and treatment of acute and chronic heart failure 2008 // EHJ, doi:10.1093/eurheartj/ehn309
