Журнал «Внутренняя медицина» 5-6(11-12) 2008
Вернуться к номеру
Ефективність та безпечність низькомолекулярного гепарину еноксапарин у лікуванні гострого коронарного синдрому
Авторы: В.З. Нетяженко, член-кор. АМН України, д.м.н., професор; Т.Й. Мальчевська, к.м.н., доцент, Національний медичний університет імені О.О. Богомольця, м. Київ
Рубрики: Семейная медицина/Терапия, Терапия
Версия для печати
У 80-х роках ХІХ століття І.П. Павлов винайшов у крові, що надходила в мале коло кровообігу, речовину, яка сповільнювала згортання крові, і перший довів печінкову природу її походження. Лише через 50 років цю речовину було виділено Хоуелом із печінки бика й названо гепарином (від лат. hepar). У подальших дослідженнях шведських учених Холмгрена і Віландера було показано, що гепарин синтезується особливими клітинами печінкових капілярів — клітинами Ерліха — і є природним антикоагулянтом. Для розуміння механізму дії антикоагулянтів слід згадати патофізіологію процесу тромбоутворення. У першій фазі згортання крові здійснюється синтез основного ферменту тромбіну з протромбіну, що синтезується в печінці. Цей процес активується тканинним тромбопластином та іонами кальцію. У другій фазі під впливом тромбіну утворюються фібрин із фібриногену. Нитки фібрину утворюють міцний «каркас» тромбу. З огляду на механізм дії антикоагулянти поділяються на дві великі групи — прямі й непрямі. Прямі антикоагулянти втручаються в процес згортання крові, безпосередньо пригнічуючи дію якогось із факторів згортання крові. Так, гепарин перешкоджає дії тромбіну й таким чином стримує процес трансформації фібриногену у фібрин. Прямі антикоагулянти діють як in vivo, так і in vitro.
Відтоді гепарин почали широко застосовувати в клінічній практиці лікарі будь-якої спеціальності як профілактичний засіб передтромботичних станів, для досягнення гіпокоагуляції при кардіоверсії у хворих із миготливою аритмією, у лікуванні життєзагрожуючих хвороб — тромбоемболії легеневої артерії (ТЕЛА), гострого коронарного синдрому (ГКС), ішемічного інсульту, в інтервенційній кардіології при ангіопластиці й аортокоронарному шунтуванні (АКШ). І сьогодні багато спланованих досліджень продовжують вивчати порівняльну ефективність, безпечність і можливий ризик застосування гепарину.
У рекомендаціях 2008 року велика увага приділяється особливостям антитромбінової терапії, зокрема використанню гепаринів, блокаторів глікопротеїнових рецепторів ІІв/ІІІа, бівалірудину, навантажувальних та курсових доз клопідогрелю при виконанні первинної ангіопластики або проведенні тромболітичної терапії (ТЛТ).
Безсумнівно, використання ТЛТ при ГКС із елевацією сегмента ST не вирішує проблему реперфузії ушкодженої ділянки міокарда. Відомо, що в 10–15 % пацієнтів тромби в коронарних артеріях стійкі до дії тромболітиків, за даними деяких авторів, у 40 % хворих нечутливість на введення тромболітика пов’язана з певними генними змінами (наявність алеля лейцину (Leu) в ХІІІа факторі згортання крові), що призводить до зниження ефекту тромболітичної терапії [2, 11]. Основною причиною первинної резистентності до реканалізації внутрішньокоронарного тромбу необхідно вважати гетерогенність. Тобто різноманітні ділянки, багаті тромбоцитами й еритроцитами, є неоднаково чутливими до ТЛТ. Багаті тромбоцитами тромби утворюються при глибокому ушкодженні фіброзного остова атеросклеротичної бляшки з її розривом й «оголенням» колагену й холестерину, до яких легко прилипають тромбоцити. Такі тромби резистентні до лізису. Іншими можливими причинами неефективності тромболізису є механічне передавлення судини ззовні в результаті крововиливу в бляшку, її розриву або розшарування коронарної артерії, а також варіабельність фібринолітичної відповіді на тромболітичний агент, його антигенність [6, 9].
Додаткове призначення гепарину пацієнтам, які отримують аспірин або фібринолітичну терапію, дає можливість попередити близько п’ятдесяти смертельних результатів на 1000 пацієнтів, декілька десятків реінфарктів та тромбоемболічні ускладнення. У практичних керівництвах Американської колегії кардіологів/Американської асоціації серця (АКК/ААС) щодо лікування ГКС з елевацією сегмента ST і без неї комбіноване призначення гепарину та аспірину вірогідно знижує ризик розвитку смерті та реінфаркту міокарда протягом першого тижня лікування. Так, протягом останніх десятиріч, гепарин став невід’ємною частиною лікування ГКС.
Нефракціонований гепарин (НФГ), прямий інгібітор тромбіну, визнаний обов’язковим препаратом у пацієнтів із Q-інфарктом міокарда за умов проведення системного тромболізису фібриноспецифічними тромболітичними засобами. Відомо, що для реалізації антикоагулянтного ефекту гепарину потрібний кофактор — антитромбін ІІІ. Численні дослідження підтвердили ефективність стандартного НФГ у зниженні ризику гострого інфаркту міокарда, рефрактерної стенокардії й судинної смерті у хворих на нестабільну стенокардію. Але подальші дослідження показали, що більшого ефекту в зниженні ризику судинних подій у хворих із ГКС без підйому сегмента ST можна досягти при поєднанні гепарину з аспірином. При цьому слід підкреслити, що ефективність НФГ при ГКС показана лише при внутрішньовенному його введенні.
НФГ пригнічує утворення тромбу, виступаючи каталізатором інактивації фактора IIа ендогенними антикоагулянтами. Вивчення варіабельності антикоагулянтної відповіді при застосуванні НФГ вказує на те, що фіксована доза гепарину при його інфузії впродовж доби не викликає адекватного підвищення активованого часткового тромбінового часу (АЧТЧ) у ранкові години. Має місце також варіабельність відповіді на введення однакової дози препарату, можливість інактивації компонентами плазми, активація агрегації тромбоцитів. Хоча антикоагулянтний ефект тривалої інфузії гепарину виникає відповідно до циркадної варіабельності, клінічне значення цього поки що не встановлене [7].
Незважаючи на ефективність у лікуванні ГКС, традиційний НФГ має також і суттєві недоліки. Після закінчення введення НФГ тромботичний процес може повторно активуватися у вигляді рикошетної відповіді. Так, в одному з досліджень частота ішемічних ускладнень різко збільшувалась у перші 96 годин після відміни НФГ. Одинадцять пацієнтів групи НФГ потребували невідкладної реваскуляризації, тоді як у групах плацебо, аспірину й комбінації аспірину з НФГ її проведення було необхідним лише 2 хворим (р < 0,01).
У деяких випадках введення НФГ призводить до розвитку гепариніндукованої тромбоцитопенії. Хоча остання є достатньо нечастим явищем (1–3 % випадків), вона викликає занепокоєння із двох причин. По-перше, тромбоцитопенія пов’язана з утворенням тромбозів дрібних та великих судин, що можуть призводити до гострого ІМ, цереброваскулярних катастроф, ниркової недостатності та ТЕЛА. По-друге, розвиток тромбоцитопенії потребує негайної відміни НФГ, що, у свою чергу, може стати тригером розвитку рикошетної гіперкоагуляції, збільшуючи ризик ішемічних ускладнень.
Лікування НФГ вимагає частого проведення моніторування (кожні 4 години контролю АЧТЧ) та регулювання дози за допомогою інфузомата. Однак навіть за умови дотримання всіх вимог у значної кількості пацієнтів не вдається досягти бажаного ступеня гіпокоагуляції. Через низьку біодоступність підшкірного введення (п/ш) гепарину надається перевага внутрішньовенній (в/в) тривалій інфузії щонайменше впродовж 2 діб із подальшим переходом на підшкірне його введення.
НФГ складається з молекулярних комплексів лінійних полісахаридних ланцюгів різної хімічної структури. Під час біосинтезу гепарину ці ланцюги займають відповідне місце на протеїновому матриксі, утворюючи глікоформи. У процесі вироблення низькомолекулярного гепарину (НМГ) довгі ланцюги НФГ фрагментують у короткі за допомогою відповідних хімічних та ензиматичних процесів деполімеризації. Вироблення кожного окремого НМГ пов’язане зі специфічністю процесів деполімеризації, тому вони мають відмінності у структурі, що призводить до розбіжностей у фармакологічній активності та показаннях до клінічного призначення. Усі НМГ мають менший кліренс, ніж НФГ, слабкий зв’язок з ендотеліальними клітинами та протеїнами плазми, кращу біодоступність, як наслідок — кращу передбачувальну антикоагулянтну активність.
Відмінності між НМГ та НФГ впливають на характер лікування.
По-перше, НФГ призначають у госпітальних умовах внутрішньовенно, титруючи дози, під контролем лабораторних показників. НМГ вводять підшкірно, без внутрішньовенного болюсу. Лабораторний моніторинг антикоагуляції не потрібний.
По-друге, рівень напівжиття НМГ у плазмі у 2–5 разів більше порівняно з НФГ. Цей ефект є наслідком високої спорідненості НФГ до макрофагів та ендотеліоцитів, що призводить до більш швидкої елімінації в печінці.
По-третє, суміш полісахаридних ланцюгів НФГ впливає на варіабельність очікуваних клінічних ефектів, таких як адсорбція, тривалість дії, розбіжності характеристик різних комерційних гепаринів.
Ефективна антикоагулянтна терапія НФГ також залежить від ряду факторів, головними з яких є ступінь активності прокоагулянтної ланки, про визначення якої йшлося вище. У сучасних умовах попередження виникнення несприятливих подій за допомогою призначення антикоагулянтної терапії часто межує з високим ризиком геморагічних ускладнень. Хворі на ГІМ із високим ризиком кровотеч, як правило, старечого віку, із некоригованою гіперліпідемією, із характерними змінами в крові у вигляді високого вмісту грубодисперсних білків, із надлишком інгібіторів фібринолізу [1–3]. У цих хворих частіше визначають зниження активності антитромбіну ІІІ [2].
Низькомолекулярні гепарини мають ряд фізіологічних переваг над стандартним гепарином: краще запобігання новому утворенню тромбіну внаслідок більшого пригнічення фактора Ха, краща передбачувана кінетика, менше зв’язування з протеїнами, менша активація тромбоцитів, нижча частота гепариніндукованої тромбоцитопенії, відсутність необхідності контролю АЧТЧ. Ефективність НМГ вивчена у великих дослідженнях із лікування ГКС з елевацією сегмента ST та без неї, у тому числі в комбінації з фібринолітичними засобами. У трьох нещодавно опублікованих ангіографічних дослідженнях відзначалося, що застосування еноксапарину або дельтапарину супроводжувалося тенденцією до зменшення ризику реоклюзії або більш пізнім збереженням прохідності інфаркт-залежної артерії. У дослідженні ASSENT-3 (2001), першому великому дослідженні із застосуванням НМГ еноксапарин (30 мг внутрішньовенно болюсно й 1 мг/кг кожні 12 годин) протягом максимум 7 днів разом із тенектеплазою, відзначалося зменшення ризику реінфаркту та внутрішньогоспітальної рефрактерної ішемії порівняно з гепарином. Не спостерігалось збільшення частоти інтракраніальних крововиливів порівняно з гепарином. Тенденція до зменшення смертності через 30 днів також свідчила на користь еноксапарину.
У дослідження ASSENT-3 PLUS (2002) догоспітальне призначення еноксапарину супроводжувалося істотним збільшенням внутрішньочерепних крововиливів порівняно із використанням гепарину в пацієнтів віком понад 74 роки. Застосування ТЛТ у літніх пацієнтів у комбінації із НМГ ще потребує подальшого вивчення.
Дія НМГ не лише обмежується вираженим впливом на Ха і ІІ фактори згортання крові, у чому й проявляється відмінність антикоагулянтного ефекту. Визначення в попередніх дослідженнях ролі запалення у формуванні ішемії міокарда, нестабільності атеросклеротичної бляшки внаслідок її ерозії чи розриву підтвердило протизапальний ефект гепаринів. Так, було встановлено, що гепарин інігібує індукцію індуцибельної нітрооксидсинтетази цитокінів ендотеліальними клітинами шляхом модуляції mRNA — власне нітрит оксиду виступає реагентом, таким чином пояснюється природа ішемії. Цей факт став приводом до застосування гепаринів при автоімунних процесах, зокрема при гломерулонефритах, системних захворюваннях сполучної тканини. Відомо, що проліферація гладком’язих структур частково відповідає за патологічні зміни в судинах, зокрема атеросклероз, гіпертензію й рестеноз після ангіопластики. Призначення НМГ призупиняє їх прогресування.
Вираженість проліферативних процесів гладком’язих клітин є ключем для пізнання механізмів, патогенезу ураження великих судин. Доведено, що еноксапарин потенційно інгібує проліферацію ендотеліальних клітин — стимуляторів ангіогенезу. Формування нових капілярів ендотеліальними клітинами є важливим для коронарних захворювань, при яких міокард в умовах гіпоксії потребує утворення нових судин для обмеження ішемічного ушкодження. На тваринних моделях було продемонстровано, що тканинний фактор росту індукує неоангіогенез при ішемії міокарда.
У виданому в 2003 році Керівництві АКК/ААС із лікування ГКС без елевації сегмента ST всім пацієнтам з імовірним або встановленим ГКС рекомендується проводити гіпокоагуляцію за допомогою п/ш введення НМГ (або в/в введення НФГ), що має супроводжувати антитромбоцитарну терапію АСК (аспірином) і/або клопідогрелем. При цьому перевага надається введенню еноксапарину над НФГ, за винятком випадків, коли в найближчі 24 години планується проведення АКШ, що вперше було підтверджено в клінічному дослідженні ESSENCE (Efficacy and Safety of Subcutaneous Enoxaparin in Non-Q-Wave Coronary Events — Ефективність та безпечність підшкірного введення еноксапарину при коронарних подіях без зубця Q). Окрім більш вираженого антитромботичного ефекту, застосування еноксапарину не асоціювалось із збільшенням частоти великих кровотеч і не було пов’язане з підвищенням ризику тромбоцитопенії порівняно з НФГ.
Порівняння еноксапарину та НМГ щодо зниження ризику виникнення смерті та нефатального інфаркту міокарда продемонструвало переваги еноксапарину над НМГ на 20 %. На сьогодні є докази більшої безпечності застосування НМГ у пацієнтів, яким планується проведення ранньої ангіопластики.
Згідно з рекомендаціями 2007 року щодо застосування антитромботичних препаратів Американської колегії із захворювань грудної клітки, для невідкладного лікування пацієнтів із ГКС без елевації сегмента ST і з нею перевага надається призначенню НМГ (табл. 1).
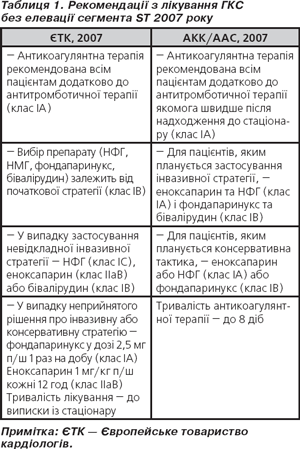
Застосування НМГ не потребує рутинних методів контролю антикоагулянтного ефекту, рекомендується продовжувати їх приймання протягом проведення АКШ, при лікуванні цієї категорії пацієнтів. Для хворих, які отримують інгібітори глікопротеїнових рецепторів — GP ІІв/ІІІа, НМГ є антикоагулянтом вибору.
На сьогодні доведено зв’язок підвищення рівня кардіальних тропонінів та ефективності антитромботичного лікування хворих із ГКС як з елевацією сегмента ST, так і без неї. У великих рандомізованих дослідженнях було показано, що сучасна антитромботична терапія (НМГ та блокатори глікопротеїнових IIb/IIIа-рецепторів тромбоцитів) ефективна у пацієнтів із ГКС, які мають підвищений рівень тропонінів у крові.
Антитромбінова терапія визнана останніми рекомендаціями та вважається основною в лікуванні пацієнтів із ГКС. Хоча на сьогодні оптимальні антитромботичні препарати не визначені, останні (оновлені) Рекомендації з лікування ГІМ з елевацією сегмента SТ АКК/ААС 2007 року, як і ГКС без елевації сегмента SТ, приділяють більше уваги використанню НМГ, а саме еноксапарину [3, 4].
Деякі великі рандомізовані дослідження, присвячені проблемі лікування ГІМ з елевацією сегмента ST або без неї, показали покращання наслідків лікування при застосуванні НМГ еноксапарин порівняно з НФГ [8]. Перші великі дослідження, що показали кращі результати лікування еноксапарином хворих на ГКС, були проведені в середині дев’яностих років минулого століття.
На сьогодні існує більше десяти міжнародних рандомізованих досліджень (загальна кількість хворих — близько 50 тисяч), у яких було показано покращання прогнозу перебігу ГІМ у разі лікування еноксапарином.
Баланс між ефективністю та безпечністю еноксапарину продовжує обговорюватися в науковій літературі, оскільки це чи не єдиний препарат, що показав свою перевагу над НФГ при лікуванні хворих із ГКС ще в 1997 році. Еноксапарин — перший із НМГ, що був ухвалений FDA для медичного застосування в США в 1993 році.
У сучасній літературі є результати 13 досліджень, у яких порівнювалася антикоагулянтна терапія еноксапарином та НФГ, загальна кількість хворих — 49 088.
Призначення еноксапарину проводилося за такою схемою: 30 мг внутрішньовенно болюсно, надалі — 1,0 мг/кг двічі на день підшкірно протягом 3–8 днів. Схема призначення НФГ була стандартною: 60 ОД/кг в/в болюсно (або 5000 ОД), з одночасною інфузією препарату з розрахунку 12 ОД/кг за годину (або 1000 ОД/год) протягом 2–4 днів.
У дослідженні HEART II (2001) інфузійна доза гепарину була більшою — 15 ОД/кг за годину. Обов’язковою умовою гепаринотерапії вважався контроль частково активованого тромбопластинового часу, що повинен бути більшим за нормальне значення в 1,5–2 рази.
У дослідження INTERACT (2003), SYNERGY (2004), A to Z (2004) були включені хворі із ГКС без елевації сегмента SТ, 80 % із них мали позитивний тропоніновий тест, що свідчило про високий ризик несприятливих подій.
За результатами аналізу, комбінована кінцева точка (смерть або нефатальний ІМ) серед хворих із ГКС, які отримували еноксапарин, була меншою порівняно з НФГ (9,8 проти 11,4 %, відношення шансів (ВШ) 0,84; 95% ДІ 0,76–0,92; р < 0,001).
Інша комбінована кінцева точка, що включала поряд зі стандартними подіями смерть, нафатальний ІМ та негативний клінічний наслідок — нефатальні великі кровотечі, — була також нижчою в групі еноксапарину: 12 проти 13,5 %; ВШ 0,90; 95% ДІ 0,81–1,003; р = 0,051 (рис. 1).
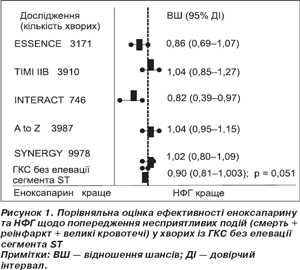
Низька вірогідність може бути пов’язана з певною гетерогенністю результатів досліджень щодо кількості кровотеч або залежить від дизайну дослідження: у хворих на ГІМ без елевації сегмента SТ призначення НФГ характеризувалося дещо більшими ініціальним болюсом та загальною інфузійною дозою [8].
Серед 27 131 хворого на ГІМ з елевацією сегмента SТ загальна частота несприятливих подій визначалася рідше в разі призначення еноксапарину (11,1 проти 12,9 %; ВШ 0,84; 95% ДІ 0,73–0,97; р = 0,018) (рис. 2).
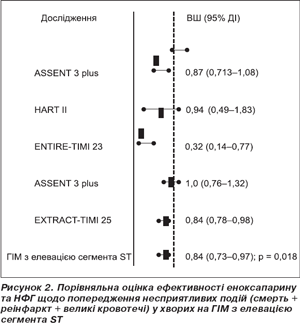
Більшість хворих на ГІМ з елевацією сегмента SТ отримували ТЛТ (переважно — фібрин-специфічну). Зменшення частоти смертей, реінфарктів або великих кровотеч визначалося навіть при виключенні результатів досліджень із великою вибіркою хворих (наприклад, EXTRACT-TIMI 25 — 20 479 хворих).
Майже вірогідна 20% перевага еноксапарину над НФГ щодо зменшення несприятливих подій зберігалася на тривалий час (11,5 проти 13,2 %; ВШ 0,80; 95% ДІ 0,62–1,04; р < 0,09).
Беручи до уваги розбіжності порівняльного впливу еноксапарину на ранній прогноз ГІМ з елевацією сегмента ST та без неї ми проаналізували вплив досліджуваного препарату на кожний окремий компонент — смерть, рецидив ІМ, велику кровотечу. У цілому у групі хворих на ГІМ без елевації сегмента ST не було знайдено вірогідних відмінностей у смертності між хворими, які отримували еноксапарин та НФГ (5,0 проти 5,3 %; ВШ 0,94; 95% ДІ 0,87–1,02; р = 0,14), кількість реінфарктів була вірогідно меншою в групі еноксапарину на 25,0 % (5,5 проти 6,9 %; ВШ 0,75; 95% ДІ 0,65–0,86; р <0,001), тоді як частота великих кровотеч вірогідно була вищою при застосуванні еноксапарину (4,3 проти 3,4 %; ВШ 1,25; 95% ДІ 1,04–1,5; р = 0,019).
Отже, в основних положеннях антитромботичного лікування керівництва Європейського товариства кардіологів 2007 року рекомендоване застосування антикоагулянтів у всіх хворих на додаток до антитромбоцитарної терапії (клас ІА). Стратегія антикоагулянтної тактики базується відповідно до визначеного ризику щодо розвитку ішемічних подій та ймовірності кровотеч (клас ІВ). Вибір антикоагулянтної терапії залежить від початкової стратегії лікування: невідкладної інвазивної, ранньої інвазивної то консервативної (клас ІВ). При невідкладній (ургентній, терміновій) інвазивній стратегії слід негайно вдатися до введення НФГ (клас ІС), еноксапарину (клас ІіаВ) або бівалірудину (клас ІВ). За умов неургентної ситуації, при неприйнятому рішенні щодо ранньої інвазивної чи консервативної стратегії рекомендується фондапаринукс з огляду на сприятливий профіль «ефективність/безпечність»; еноксапарин із менш сприятливим профілем «ефективність/безпечність» — при низькому ризику кровотеч (клас IIаВ). Щодо інших низькомолекулярних гепаринів (дальтепарин, надрапарин) не можна дати рекомендації.
При процедурі ангіопластики приймання антикоагулянтів продовжується незалежно від використання НФГ, еноксапарину, бівалірудину, тоді як при прийманні фондапаринуксу слід додатково використовувати НФГ у стандартній дозі (болюсно 50–100 ОД/кг ) (клас ІIаС).
Антикоагулянтна терапія може бути призупинена в межах 24 годин після інвазивної процедури (клас ІIаС). При консервативній стратегії еноксапарин або інші НМГ можуть бути продовжені до виписки (клас ІВ).
Отже, проведені дослідження показали клінічну ефективність, безпечність і переваги застосування еноксапарину при ГКС порівняно із НФГ.
1. Нетяженко В.З., Батушкін В.В. Різні режими антитромбінової терапії еноксапарином у гострому періоді інфаркту міокарда та їх значення в покращенні прогнозу у хворих похилого віку // Внутрішня медицина. — 2008. — № 1. — С. 17-21.
2. Пархоменко А.Н., Иркин О.И., Брыль Ж.В. и др. Тромболитическая терапия в лечении острого инфаркта миокарда: клинико-инструментальные критерии эффективности и возможности оптимизации вмешательства // Сб. науч. трудов «Достижения и перспективы развития терапии в канун ХХI века». — Харьков, 2000. — С. 321-329.
3. Anderson J.L., Adams C.D., Antman E.M. et al. ACC/AHA 2007 guidelines for the management of patients with unstable angina/non-ST-elevation myocardial infarction: report of ACC/AHA task force on practice guidelines (Writing committee to revise the 2002 guidelines) // J. Am. Coll. Cardiol. — 2007. — Vol. 50. — e1-e157.
4. Antman E.M., Hand M., Armstrong P.W. et al. 2007 focused update of the ACC/AHA 2004 guidelines for the management of patients with ST-elevation myocardial infarction. Task force on practice guidelines // J. Am. Coll. Cardiol. — 2008. — Vol. 51. — Р. 210-247.
5. Mantelescot G., Bol-dit-Sollier C., Chibedi D. et al. Comparison of effects on marcers of blood cell activation of enoxaparin, dalteparin, and UFH in patients with unstable angina pectoris or non-ST-segment elevation acute myocardial infarction (the ARMADA study) // Am. J. Cardiol. — 2003. — Vol. 91. — Р. 925-930.
6. Baird S.H., Menown I.B., McBrige S.J. et al. Randomized comparison of enoxaparin with unfractioned heparin following fibrinolytic therapy for acute myocardial infarction // Eur. Heart J. — 2002. — Vol. 23. — Р. 267-272.
7. Giraldez R.R., Nicolau J.C., Corbalan R. et al. Enoxaparin is superior to unfractionated heparin in patients with ST elevation myocardial infarction undergoing fibrinolysis regardless of the choice of lytic: an ExTRACT-TIMI 25 analysis // Eur. Heart J. — 2007. — Vol. 28. — Р. 1566-1573.
8. Murphy S.A., Gibson C.M., Morrow D.A. et al. Efficacy safety of the low-molecular weigh heparin enoxaparin across the acute coronary syndrome spectrum: meta-analysis // Eur. Heart J. — 2007. — Vol. 28. — Р. 2077-2086.
9. Petersen J.L., Mahaffey K.W., Hasseiblad V. et al. Efficacy and bleeding complications among patients randomized to enoxaparin or unfractioned heparin for antithrombin therapy in non-ST-elevation acute coronary syndromes: a systematic overview // JAMA. — 2004. — Vol. 292. — Р. 89-96.
10. Roe M.T., Parsons L.S., Poilak C.V. et al. Quality of care by classification of myocardial infarction: treatment patients for ST-elevation myocardial infarction // Arch. Intern. Med. — 2005. — Vol. 165. — Р. 1630-1636.
