Журнал «Внутренняя медицина» 5-6(11-12) 2008
Вернуться к номеру
Раннє судинне старіння як клінічна модель для розуміння кардіоваскулярного ризику
Авторы: Peter Nilsson, MD, PhD, Department of Clinical Sciences, University Hospital, Malmо, Sweden
Рубрики: Семейная медицина/Терапия, Терапия
Версия для печати
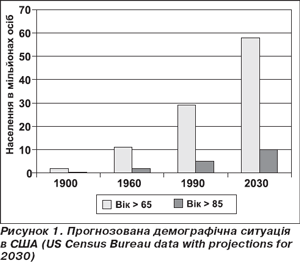
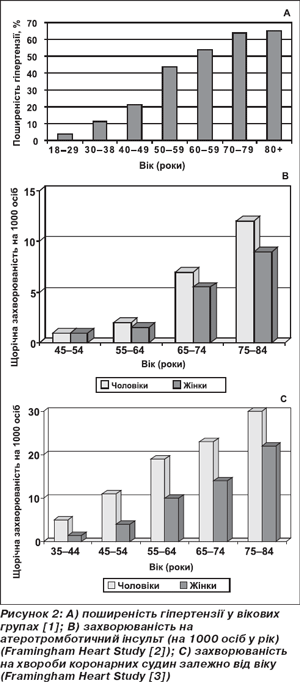
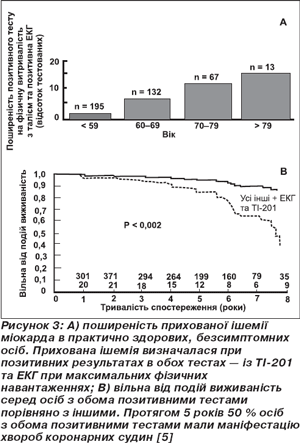
Усі ссавці живуть, але тривалість життя мають різну. Цей процес відшліфований еволюційним відбором та репродуктивною фізіологією у взаємозв’язку з харчуванням, метаболізмом та функціонуванням ендокринної системи. Ми живемо в старіючому суспільстві; у США сьогодні нараховується понад 35 мільйонів осіб віком понад 65 років. Ця цифра, згідно з прогнозом, подвоїться до 2030 року (рис. 1). Старіння стало однією з критичних проблем сучасного індустріального світу, оскільки середній вік популяції і, отже, частота асоційованих із віком захворювань різко зростають та створюють додатковий тягар, оскільки хворі вимагають подовженого терміну лікування та госпіталізації й інших послуг. Незважаючи на останні досягнення медицини, серцево-судинні захворювання (ССЗ) залишаються найбільш частою причиною захворюваності та смертності. Хоча епідеміологічними дослідженнями визначено, що рівень ліпідів, цукровий діабет, сидячий спосіб життя та генетичні фактори є факторами ризику захворювання коронарних артерій, гіпертензії, хронічної серцевої недостатності та інсульту, квінтесенцією ризику ССЗ у нашому суспільстві однозначно є похилий вік (рис. 2). Вік безпосередньо є суттєвим фактором ризику ССЗ, оскільки специфічні патофізіологічні механізми, що лежать в основі цих хвороб, нашаровуються на серцевий та судинний субстрат, що вже змінений процесом старіння [4]. Але важливо те, що з віком не тільки різко погіршується явна клінічна картина ССЗ, але те ж відбувається й із субклінічними ураженнями, або прихованими, або невиявленими захворюваннями, такими як, наприклад, атеросклероз коронарних судин (рис. 3) [6]. Ризик ССЗ асоційований із процесом старіння взагалі та судинної стінки зокрема. Похилий вік впливає на функціонування та структуру судинної стінки. Сутність старіння судинної стінки полягає в таких процесах: збільшення жорсткості артерій (збільшення вмісту колагену та зменшення еластину), збільшення пульсового тиску (ПТ) та швидкості пульсової хвилі (ШПХ) — особливо вище за 12 м/с; глікозилювання судинної стінки протеїнами; ендотеліальна дисфункція; зменшення продукції NO, оксидантний стрес; локальне й периваскулярне запалення; дисфункція капілярів; укорочення теломерів.


Є декілька можливих пояснень домінуючого впливу віку на вірогідність виникнення серцево-судинних хвороб. Одне з них таке: старіння — синонім хвороби; проте багато людей досягають старості без ознак цих хвороб. Є й інше пояснення «епідемії» серцево-судинної хвороби в літніх людей: певні інші фактори ризику видозмінюються в числі або тяжкості із збільшенням віку. Пов’язана із вищезазначеним, але дещо відмінна ідея, що із збільшенням віку зростає тривалість впливу залежних від віку факторів ризику. Згідно з цією думкою, час опосередковано сприяє зростанню ризику виникнення, збільшення тяжкості й міри патофізіологічних проявів ССЗ у літніх людей. Дещо інше уявлення — те що серцево-судинна структура й функція змінюються з часом унаслідок процесу старіння і що протягом довгого часу цей процес ушкоджує субстрат, який також відіграє важливу роль у патофізіологічних механізмах хвороби. Згідно з цим уявленням, у літніх людей підвищений ризик зіткнення з вищезазначеними хворобами визначається взаємодією хвороби та віку. Іншими словами, вік впливає на серйозність проявів захворювань. Отже, пов’язані з віком зміни в серцево-судинній структурі й функції стають «партнерами» з патофізіологічними механізмами хвороби і визначають поріг, серйозність і прогноз виникнення ССЗ у літніх людей. Звичайно, насправді взаємодія складніша, у ній беруть участь вік, численні фактори ризику і генетичні фактори. При дослідженні даного питання дослідниками зазвичай вводиться змінна, що залежить від віку, наявності або відсутності хвороби, а також може включати деякі нові показники субклінічного ураження органів, і якщо змінна визначена як вигідна або шкідлива щодо серцево-судинної структури та функції, то крайні групи досліджуваних вважають «вдало» або «невдало» старіючими відповідно. «Невдале» старіння в даному контексті не синонімічне з наявністю клінічної хвороби й розглядається як фактор ризику майбутнього ССЗ. Отже, «невдале» старіння — це прояв взаємодії процесу судинного старіння та специфічних аспектів патофізіології судинної хвороби. Головна думка даного огляду та, що найбільш суттєві ССЗ людей похилого віку та пов’язані зі старінням зміни в серцево-судинній структурі та функції переплітаються одні з одними та є взаємозалежними [6].

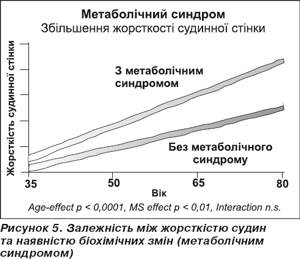
Жорсткість судинної стінки розвивається внаслідок складної взаємодії між стійкими та динамічними властивостями, що втягують у процес структурні та клітинні елементи судинної стінки. Ці судинні зміни перебувають під впливом як гемодинамічних умов, так і «зовнішніх факторів», таких як гормони, сіль, рівень глюкози тощо (рис. 4). Дані біохімічні порушення можуть призводити до структурного ушкодження в судинній стінці, що може бути доведене простим порівнянням жорсткості судинної стінки в практично здорових осіб та в осіб із порушеними процесами біохімічного обміну, наприклад метаболічним синдромом (рис. 5), при якому жорсткість судинної стінки значно зростає з віком. Одномоментні поперечні поглиблені дослідження показали, що збільшення жорсткості стінки та дилатація є характерними структурними змінами, що виникають у судинах еластичного типу. Посмертні дослідження визначили, що потовщення стінки аорти, яке виникло внаслідок старіння, відбувається переважно за рахунок потовщення інтими, навіть у популяціях із низькою захворюваністю на атеросклероз. Велику роль у розвитку підвищеної жорсткості судинної стінки відіграють молекули еластину та колагену. Молекули колагену виконують функцію каркасу судинної стінки й захищають її від надмірного розтягнення. Молекули ферментативно зв’язані поперечними зв’язками між собою, що робить їх не розчинними щодо гідролітичних ферментів. Ушкодження міжмолекулярних зв’язків призводить до «розпушування» колагенового матриксу. Крім того, унаслідок його повільного розщеплення гідролітичними ферментами колаген схильний до неферментативного глікозилювання зв’язків. Це призводить до збільшеного вмісту колагену, часто з більш неорганізованим та дисфункціональним розподілом ниток. Молекули еластину теж стабілізовані поперечними зв’язками і формують десмозин та ізодесмозин. Розрив цих поперечних зв’язків сприяє послабленню сітки еластину зі схильністю до мінералізації кальцієм та фосфором, разом із тим збільшуючи жорсткість судини. Крім того, активація різних серинів та металопротеїназ призводить до вироблення ушкоджених та нестійких молекул. Ушкодження механізмів вироблення еластину та молекулярних механізмів відновлення — репарації — додатково сприяє втраті еластичних властивостей судини.
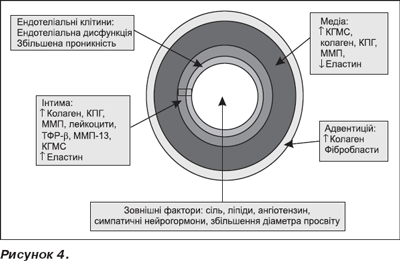
Збільшення жорсткості судин також виникає внаслідок впливу кінцевих продуктів глікозилювання (КПГ), що є результатом неферментативного глікозилювання протеїнів, із формуванням незворотних зв’язків між довго живучими білками, такими як колаген. Змінений таким чином колаген більш жорсткий та менш сприйнятливий до гідролітичного розчинення. Аналогічно молекули еластину теж є сприйнятливими до порушення зв’язків унаслідок дії КПГ, у результаті чого зменшується вміст еластину в стінці судини. КПГ також можуть ушкоджувати функцію ендотеліальних клітин із вироблення NO та збільшувати кількість оксидантів, таких як пероксинітрит. Через їх рецептори надсімейства імуноглобулінів КПГ стимулюють вироблення стресових сигналів та індукують запальну відповідь, збільшуючи експресію вільнорадикальних оксидантів, прозапальних цитокінів, факторів росту та молекул судинної адгезії. Ці медіатори можуть збільшувати щільність судин через матриксні металопротеїнази (ММП), призводячи до ендотеліальної дисфункції, що збільшує тонус клітин гладких м’язів судин (КГМС), знижує індуковану ендотелієм дилатацію судин, погіршує відповідь на ушкодження судини, впливає на ангіогенез, сприяє розвитку атеросклеротичних бляшок. Профібротична дія може також бути незалежно викликана трансформуючим фактором росту β (ТФР-β) — шлях взаємодії рецепторів КПГ із КПГ-лігандами [7].
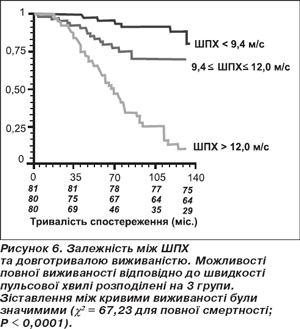
Асоційоване з віком збільшення товщини інтими-медії (ІМ) характеризується як дилатацією просвіту судини, так і зменшенням еластичності або піддатливості зі збільшенням щільності судин. У клінічній практиці для визначення щільності судин використовують такі показники: форма хвилі тиску в центральних та периферичних судинах, швидкість пульсової хвилі (ШПХ), індекс приросту тиску, рання рефлексія (відображення) хвилі. Швидкість пульсової хвилі — відносно зручний, неінвазивний індекс судинної щільності — зростає з віком як у жінок, так і в чоловіків. Збільшена ШПХ традиційно пов’язана зі структурними порушеннями медії, включаючи підвищений уміст колагену, зменшений уміст еластину, ушкодження волокон еластину та кальцифікацію. Характерне залежне від віку збільшення ШПХ продемонстроване в популяціях із малою часткою атеросклерозу або його відсутністю, вказується, що збільшена щільність судинної стінки може виникати незалежно від атеросклерозу [8], але також часто виникає в поєднанні з атеросклерозом та діабетом, що доводить важливість не лише структурних змін матриксу судин, але й механізмів регуляції функцій ендотелію, КГМС та інших аспектів структури та функції судинної стінки. ШПХ є важливим прогностичним фактором щодо довготривалої виживаності (понад 10 років). Найбільш прогностично несприятливим фактором є ШПХ понад 12 м/с, при якій через 10 років рівень виживаності складає менше 12 % (рис. 6).
Отже, якщо збільшується щільність великих артерій, центральний систолічний тиск зростає, діастолічний тиск знижується та пульсовий тиск зростає. Поздовжні дослідження великої кількості населення показали, що підвищений рівень пульсового тиску асоційований із прогресуванням потовщення ІМ і що потовщення ІМ асоційоване зі збільшенням ПТ [9]. Багато додаткових досліджень збігаються у висновку, що збільшений ПТ є незалежним фактором ризику для подальших серцево-судинних подій. Отже, підвищений ПТ відображає 3 потенційні фактори ризику: збільшення систолічного тиску, збільшення ПТ, зміну властивостей судинної стінки.
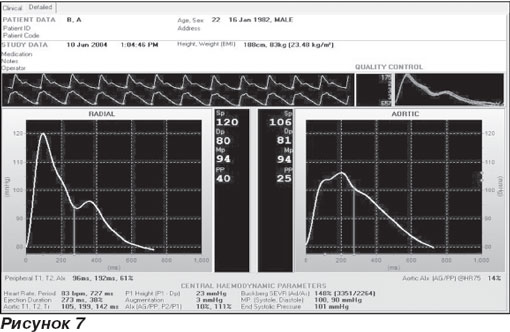
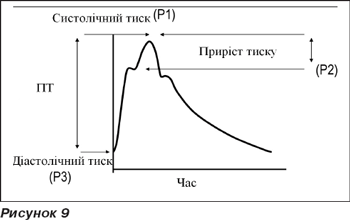
Форма тиску хвилі вказує на механічні властивості стінки судини. Для запису форми хвилі тиску використовують апланаційний тонометр. За допомогою даного приладу можна визначити форму хвилі тиску на центральних та периферичних судинах, швидкість ПТ та рутинні показники: ЧСС, тривалість викиду, рівень приросту тиску тощо (рис. 7). Нормальна форма хвилі тиску та її складові подані на рис. 8; тут схематично зображено зміни форми хвилі при збільшенні щільності судинної стінки.
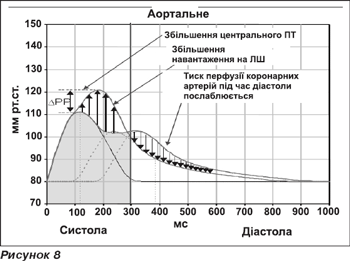
Рефлексія хвилі в серцево-судинній системі служить для двох основних цілей. За нормальних умов відображена хвиля повертається до центральної аорти в діастолу, таким чином збільшуючи діастолічний тиск в коронарних судинах. Частково відображена хвиля також повертає порцію енергії пульсу, що розсіюється в аорті. Отже, рефлексія хвилі лімітує передачу енергії пульсу на периферію, де вона може ушкодити мікроциркуляторне русло. Втрата цих, очевидно, захисних функцій відображеної хвилі впливає на патогенез виникнення багатьох серцево-судинних та не серцево-судинних супутніх факторів старіння, що є частиною можливих мікросудинних порушень, включаючи ушкодження білої речовини мозку та ниркову дифункцію.
Наслідки більш раннього повернення відображеної хвилі:
— Дане більш раннє повернення до серця рефлексії хвилі тиску (результат збільшення жорсткості артерій) змінює корінь форми хвилі тиску.
— Зростання центрального ПТ збільшує ризик інсульту та ниркової дисфункції.
— Збільшення навантаження на ЛШ призводить до збільшення маси ЛШ та прискорення прогресування гіпертрофії ЛШ та СН.
— Послаблення тиску перфузії коронарних артерій під час діастоли збільшує ризик ішемії міокарда.
Щоб вирахувати тиск відображеної хвилі за наявності точки перегину перед піком тиску (рис. 9), тобто коли має місце приріст тиску, необхідно від систолічного тиску відняти тиск у першій точці перегину. Відстань від точки першого перегину до піку хвилі тиску називається приростом тиску. При відсутності перегину кривої до піку хвилі тиску приріст вважається рівним 0.
Можна визначити клінічні умови, асоційовані зі збільшенням щільності судин та/або прискоренням рефлексії хвилі (табл. 1)
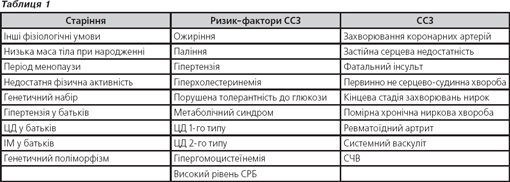
Як бачимо, значна частина факторів старіння, ризик-факторів ССЗ є такими, що підлягають модифікації внаслідок зміни стилю життя або за допомогою медикаментозного лікування, та залежать від соціального, освітнього рівня особи та коплайєнсу. Це свідчить про важливу роль превентивних заходів в попередженні розвитку залежних від віку змін структури та функції судин та ССЗ.
Виявлено, що схильність до багатьох серцево-судинних захворювань формується ще при народженні. Низька вага при народжені є ризик-фактором для численних захворювань:
— гіпертензії;
— ЦД 2-го типу;
— гіперліпідемії;
— інсулінорезистентності;
— метаболічного синдрому;
— судинної дисфункції;
— збільшення щільності артерій;
— захворювання коронарних артерій.
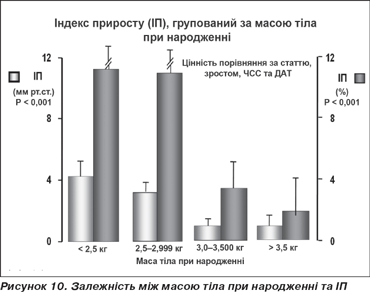
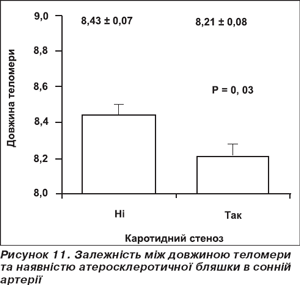
Закономірність щодо збільшення щільності при більш низькій масі тіла при народжені продемонстрована на рис. 10 [10]. Також виявлена залежність між довжиною теломери та величиною атеросклеротичної бляшки в коронарних артеріях, що свідчить про важливу роль генетичного набору в процесах старіння та розвитку ССЗ (рис. 11).
Які ж заходи для захисту судинної стінки мають застосовуватися в клініці та самостійно для профілактики ССЗ?
— Припинення паління (NRT, bupropion, varenicline);
— контроль ліпідів (статини, комбінована терапія) (WOSCOP trial // Lancet 2007, Lancet 2008, meta-analysis for DM);
— контроль АТ (ESH/ESC Guidelines 2007);
— блокада РААС (іАПФI, БРА) (ONTARGET 2008);
— контроль глікемії (метформін — UKPDS, глітазони);
— антиоксиданти? вітаміни? продукти кінцевого глікозилювання?
— натуральна антиоксидантна дієта, з обмеженням солі.
Підсумовуючи сказане, можна зробити такі висновки:
1. Старіння є біологічним феноменом у всіх ссавців, одним із його маркерів є довжина теломерів на кінці спіралі ДНК
2. Раннє біологічне старіння може бути асоційоване з раннім судинним старінням, хронічним запаленням, ендотеліальною дисфункцією та атеросклерозом та здатне призводити до більш ранньої маніфестації ССЗ.
3. Для виникнення швидкого судинного старіння є дві моделі — генетична (прогерія) та модель стилю життя (паління).
4. Захист судин (статинами, антигіпертензивними препаратами та ін.) може відстрочувати судинне старіння.
За матеріалами ІІ Національного конгресу лікарів внутрішньої медицини
Підготували Ю.О. Мишковська, доцент кафедри пропедевтики внутрішньої медицини № 1
В.В. Таранчук,
магістр медицини кафедри пропедевтики
внутрішньої медицини № 1
Національного медичного університету
імені О.О. Богомольця
1. Burt V.L., Whelton P., Roccella E.J. et al. Prevalence of hypertension in the US adult population: results from the Third National Health and Nutrition Examination Survey, 1988–1991 // Hypertension. — 1995. — 25. — 305-313.
2. Wolf P.A. Lewis A. Conner lecture: contributions of epidemiology to the prevention of stroke // Circulation. — 1993. — 88. — 2471-2478.
3. Framingham Study: An Epidemiological Investigation of Cardiovascular Disease. Section 34. NIH Publication № 87–2703 // Ed. by W.B. Kannel, P.A. Wolf, R.J. Garrison. — Bethesda, Md: National Heart, Lung and Blood Institute, 1987.
4. Pepe S., Lakatta E.G. Aging hearts and vessels: Masters of adaptation and survival // Cardiovasc. Res. — 2005 May 1. — 66(2). — 190-193.
5. Fleg J.L., Gerstenblith G., Zonderman A.B. et al. Prevalence and prognostic significance of exercise-induced silent myocardial ischemia detected by thallium scintigraphy and electrocardiography in asymptomatic volunteers // Circulation. — 1990. — 81. — 428-436.
6. Lakatta E.G., Levy D. Arterial and Cardiac Aging: Major Shareholders in Cardiovascular Disease Enterprises: Part I // Circulation. — 2003. — 107. — 139-146.
7. Zieman S.J., Melenovsky V., Kass D.A. Mechanisms, Pathophysiology, and Therapy of Arterial Stiffness // Arterioscler. Thromb. Vasc. Biol. — 2005 May 1. — 25(5). — 932-943.
8. Avolio A. Genetic and environmental factors in the function and structure of the arterial wall // Hypertension. — 1995. — 26. — 34-37.
9. Zureik M., Touboul P.-J., Bonithon-Kopp C. et al. Cross-sectional and 4-year longitudinal associations between brachial pulse pressure and common carotid intima-media thickness in a general population: the EVA Study // Stroke. — 1999. — 30. — 550-555.
10. Lurbe et al. // Hypertension. — 2003. — 41.
