Журнал «Внутренняя медицина» 5-6(11-12) 2008
Вернуться к номеру
Ураження серця при гіпереозинофільних синдромах: огляд літератури та клінічний випадок
Авторы: Р.Р. Коморовський, к.м.н., Т.О. Паламар, к.м.н., Кафедра внутрішньої медицини Тернопільського державного медичного університету ім. І.Я. Горбачевського, Л.Т. Крамар, Гематологічний відділ Тернопільської обласної клінічної лікарні
Рубрики: Семейная медицина/Терапия, Терапия
Версия для печати
У вітчизняній медичній літературі є лише поодинокі повідомлення, присвячені проблемі гіпереозинофілії [1], а праць, у яких розглядається ураження серця при цих станах, практично немає. При цьому ураження серця при гіпереозинофільних синдромах спостерігається у 40–60 % випадків [2, 3]. Наша мета — привернути увагу до проблеми кардіоміопатії на фоні гіпереозинофілії, оскільки її розвиток є провісником несприятливого прогнозу та однією з основних причин захворюваності та смертності хворих. Водночас на початковій стадії гіпереозинофільна кардіоміопатія може бути оборотною: її своєчасна діагностика та правильне лікування дозволяють досягти регресування симптомів та поліпшити виживаність хворих [4, 5].
Питання термінології та класифікації в історичному аспекті
У 1936 р. швейцарський лікар Вільгельм Леффлер описав два випадки ураження серця у хворих із вираженою периферичною еозинофілією [6]. У них спостерігали клінічні ознаки серцевої недостатності, зумовлені особливим ендоміокардіальним ураженням із запальним стовщенням ендокарда, що увійшло в медичну літературу під назвою «фібропластичний ендокардит Леффлера». Крім того, на фоні гіпереозинофілії були описані ураження легень, селезінки, печінки, шкіри, очей, які згодом було запропоновано об’єднати під назвою «гіпереозинофільні синдроми» (ГЕС) [7]. У 1975 р. Chusid та співавт. [8] запропонували діагностичні критерії ідіопатичного ГЕС, що актуальні й досі. Вони включають: 1) гіпереозинофілію (≥ 1,5·109/л) тривалістю понад 6 міс.; 2) відсутність паразитарних, алергічних та ін. хвороб, що потенційно можуть супроводжуватися еозинофілією; 3) пов’язане з еозинофілією ураження внутрішніх органів.
За останній час завдяки значному поступу у цитогенетичних та молекулярних дослідженнях стало можливим діагностувати різноманітні варіанти еозинофілій (табл. 1). Згідно з сучасною класифікацією, розрізняють первинну (клональну й ідіопатичну) та вторинні еозинофілії [9, 10]. Ідіопатичний ГЕС (синонім «ідіопатична еозинофілія»), отже, є діагнозом виключення, коли патогенетичний механізм еозинофілії встановити не вдається. Термін ГЕС є ширшим і об’єднує гетерогенну групу захворювань (характеризуються гіпереозинофілією та еозинофільною інфільтрацією тканин), органоспецифічні еозинофільні ураження (наприклад, еозинофільний езофагіт, еозинофільний гастроентерит, еозинофільний дерматит, еозинофільна пневмонія), охоплюючи при цьому й ідіопатичний ГЕС. ГЕС не включає вторинних еозинофілій.
Для характеристики ураження серця при ГЕС загальноприйнятої термінології немає. Ще не вийшов з ужитку запропонований Леффлером термін «фібропластичний ендокардит», хоча він не повністю відображає весь спектр змін з боку серця при ГЕС [11]. Поряд із ним використовують інші терміни, зокрема «еозинофільна кардіоміопатія», «гіпереозинофільний ендоміокардіальний фіброз», «еозинофільний ендоміокардит», «ендоміокардит Леффлера», «еозинофільний міокардит». Багато авторів використовують термін «ендоміокардит Леффлера» для позначення ранньої стадії ураження серця на фоні ГЕС, тоді як для позначення пізньої стадії використовується термін «ендоміокардіальний фіброз». Існує загальна думка, що ураження серця при ГЕС має риси рестриктивної кардіоміопатії і, на наш погляд, термін «гіпереозинофільний ендоміокардіальний фіброз» найкраще узгоджується з сучасною класифікацією кардіоміопатій [12].
Етіологічна класифікація рестриктивних кардіоміопатій
Типові причини:
— амілоїдоз;
— ідіопатична рестриктивна кардіоміопатія;
— тропічний ендоміокардіальний фіброз (в екваторіальних країнах).
Рідкі причини:
— саркоїдоз;
— гемохроматоз;
— гіпереозинофільний ендоміокардіальний фіброз.
Інші причини:
— склеродермія;
— хвороби накопичення (хвороба Фабрі, хвороба Гоше, синдром Гурлера, глікогенози);
— радіація;
— метастатичні ураження (наприклад, при меланомі, лімфомі).
Клінічний випадок
Хворий П.С., 38 р., із діагностованим 3 роки тому гіпереозинофільним синдромом, перебуваючи на стаціонарному лікуванні в гематологічному відділенні, проконсультований кардіологом у зв’язку з симптомами застійної серцевої недостатності. Висловлював скарги на задишку при незначних фізичних навантаженнях, серцебиття, набряки на ногах. Приймає гідроксисечовину у добовій дозі 1000 мг.
Об’єктивно:
Шкіра та слизові оболонки: без висипань.
Шия: видима пульсація яремних вен, щитоподібна залоза не збільшена.
Периферичні лімфатичні вузли: не збільшені.
Пульс: 100 за 1 хв, ритмічний.
Артеріальний тиск: 110/70 мм рт.ст.
Серце: діяльність ритмічна, І тон ослаблений, акцент ІІ тону над легеневою артерією. Систолічний шум (3/6) над верхівкою з іррадіацією в ліву аксилярну ділянку.
Частота дихання: 24 за 1 хв.
Легені: дихання везикулярне, в базальних відділах з обох боків — ослаблене з дрібнопухирчастими вологими хрипами.
Живіт: м’який; печінка на 4 см виступає з-під краю реберної дуги по правій середньоключичній лінії. Спленомегалія: селезінка пальпується на рівні пупка.
Кінцівки: набряки на гомілках і ступнях.
Лабораторні/інструментальні дослідження:
Загальний аналіз крові: еритроцити 3,60·1012/л, гемоглобін 113 г/л, кольоровий показник 1,0, тромбоцити 126·109/л, лейкоцити 23,16·109/л, лейкоцитарна формула: паличкоядерні нейтрофіли — 1 % (0,23·109/л), сегментоядерні нейтрофіли — 14 % (3,24·109/л), еозинофіли — 66 % (15,29·109/л), базофіли — 1 % (0,23·109/л), лімфоцити — 18 % (4,17·109/л), ШОЕ — 19 мм/год.
Біохімічний аналіз крові: глюкоза 4,21 ммоль/л, білірубін 16,27 мкмоль/л, АСТ 0,49 мккат/л, АЛТ 0,48 мккат/л, сечовина 6,36 ммоль/л, креатинін 0,113 ммоль/л, загальний білок 67,6 г/л.
Загальний аналіз сечі: без відхилень від норми.
Рентгенографія органів грудної клітки: застійні зміни легеневої тканини; вільна рідина у правому плевральному синусі; серце — збільшені всі камери.
ЕКГ: синусова тахікардія з частотою серцевих скорочень 98 за 1 хв. Неспецифічні ST-T зміни.
Ехокардіографія (6.11.2008 р.):
1) Діаметр аорти у початковому відділі 32 мм, аортальний клапан фіброзований, пікова швидкість трансаортального потоку 1,2 м/с, легка аортальна регургітація (ширина потоку в зоні vena contracta 3 мм, час півпадіння тиску 428 мс).
2) Дилатація обох передсердь: ліве передсердя 52 мм у передньозадньому розмірі, площею 34 см2, праве передсердя площею 32 см2.
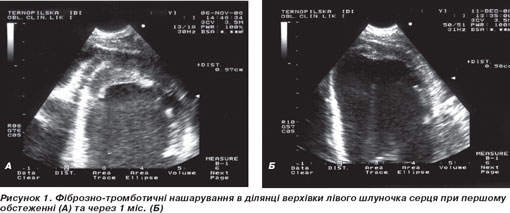
3) Лівий шлуночок (ЛШ): стінки товщиною 10–11 мм, міокард дрібнокрапчастої ехоструктури, що вказує на його інфільтрацію. Кінцево-діастолічний розмір ЛШ 69 мм, добра сегментарна та глобальна скоротливість міокарда, фракція викиду ЛШ 67 % (Simpson). Правий шлуночок теж помірно дилатований. Верхівка лівого (рис. 1А) та меншою мірою правого шлуночка облітерована ехогенною масою. Скоротливість верхівки не порушена.
4) Мітральний апарат: мітральне кільце та стулки мітрального клапана з фіброзно-склеротичними змінами, виражені фіброзні зміни хордального апарату задньої мітральної стулки, внаслідок чого обмежується її рухомість. Помірна мітральна недостатність (механізм — розширення мітрального кільця та рестриктивний рух задньої стулки). Профіль трансмітрального діастолічного потоку — рестриктивний (DecT 117 мс).
5) Профіль систолічного потоку у легеневій артерії із середньосистолічним зазубренням, що непрямо свідчить про суттєву легеневу гіпертензію. Реєструється помірна трикуспідальна регургітація, що дозволяє встановити систолічний тиск у легеневій артерії 58 (43 + 15) мм рт.ст.: помірна легенева гіпертензія.
6) Мінімальний перикардіальний випіт без ознак констрикції перикарда.
7) Нижня порожниста вена погранично розширена (25 мм), недостатньо спадається під час вдиху.
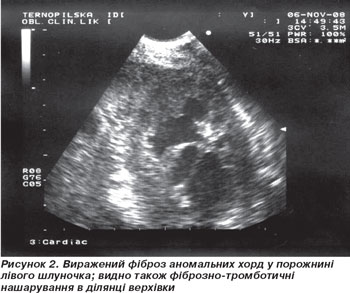
8) У порожнині ЛШ — множинні фіброзовані аномальні хорди (рис. 2).
Висновок: з урахуванням результатів клініко-лабораторних обстежень ехо-дані вкладаються у картину рестриктивної кардіоміопатії — ендоміокардіального фіброзу.
Консультативний висновок кардіолога:
Рестриктивна кардіоміопатія: гіпереозинофільний ендоміокардіальний фіброз, СН ІІ-Б (ІІІ ФК).
Хворому продовжено терапію гідроксисечовиною, додатково призначено петльові діуретики, спіронолактон, кортикостероїди, еноксапарин, у результаті чого стан покращився — кровообіг компенсовано, симптоми серцевої недостатності стабілізовано на рівні ІІ функціонального класу. Для планового лікування (поряд із гідроксисечовиною) призначено преднізолон 5 мг/день, верошпірон 25 мг/день, варфарин 2,5 мг/день під контролем міжнародного нормалізованого співвідношення в межах 2–3, фуросемід 40 мг 2–3 рази на тиждень під контролем набряків, маси тіла та ехо-контроль через місяць.
Через місяць хворий прибув для контрольного обстеження. Симптоми серцевої недостатності утримувалися на рівні ІІ функціонального класу, кровообіг на фоні призначеного лікування залишався компенсованим.
Загальний аналіз крові: еритроцити 4,00·1012/л, гемоглобін 124 г/л, кольоровий показник 0,9, тромбоцити 132·109/л, лейкоцити 15,00·109/л, лейкоцитарна формула: паличкоядерні нейтрофіли — 11 % (1,65·109/л), сегментоядерні нейтрофіли — 39 % (5,85·109/л), еозинофіли — 29 % (4,35·109/л), базофіли — 1 % (0,15·109/л), лімфоцити — 19 % (2,85·109/л), ШОЕ — 3 мм/год.
При контрольній ехокардіографії (11.12.2008 р.) виявлено зменшення фіброзно-тромботичних нашарувань у ділянці верхівки (рис. 1Б), зменшення кінцево-діастолічного розміру ЛШ до 62 мм. Правий шлуночок візуально менший, систолічний тиск у легеневій артерії 35 мм рт.ст. Інші показники — без суттєвої динаміки.
Обговорення
Наведений нами випадок ілюструє ураження серця на фоні ГЕС. У хворого спостерігалися облітерація верхівки обох шлуночків, рестриктивні розлади наповнення лівого шлуночка при нормальній його сегментарній та глобальній скоротливості, ураження мітрального та аортального клапанів. Крім того, виявлено виражені інфільтративно-фіброзні зміни наявних у лівому шлуночку аномальних сухожильних хорд (рис. 2), що, як показує ретельний аналіз доступної нам літератури, раніше ніколи ще не було описано.
Рестриктивна кардіоміопатія при ГЕС характеризується унікальними рисами, що включають облітерацію верхівки фіброзно-тромботичною масою без супутніх сегментарних розладів скоротливості, ураження клапанного апарата, в типових випадках фіброзно-тромботичні нашарування формуються під задньою стулкою мітрального клапана, що обмежує її рухомість, спричиняючи гемодинамічно вагому мітральну регургітацію [13]. Рідше вражаються трикуспідальний [14] та аортальний [15] клапани.
Ураження серця при ГЕС — поступовий процес. Рання (некротична) стадія, що характеризується інфільтрацією міокарда еозинофілами та їх токсичною дегрануляцією, як правило, не діагностується. Ехокардіографічна картина на цій стадії може бути нормальною. Згодом настає тромботична стадія з утворенням пристінкових тромбів — у цей період спостерігається високий ризик тромбоемболічних ускладнень. Тромботичні нашарування, перемішані з еозинофілами та запальними клітинами, організовуються, ендокард фіброзується, і настає пізня (фібротична) стадія, що клінічно проявляється ознаками застійної серцевої недостатності [16].
Фіброзно-тромботичні нашарування в ділянці верхівки слід диференціювати із апікальною формою гіпертрофічної кардіоміопатії: при цьому слід звернути увагу на те, що ехогенність фіброзно-тромботичних нашарувань та серцевого м’яза при ГЕС є різною. Тромбоз верхівки внаслідок апікального інфаркту міокарда також малоймовірний, якщо відсутні відповідні сегментарні розлади скоротливості. Проти пухлинного ураження серця свідчить те, що нашарування легко змінюють свою форму під час серцевих скорочень.
Ехокардіографія повинна бути обов’язковим методом обстеження у хворих із ГЕС, оскільки дозволяє з достатньою чутливістю виявити фіброзно-тромботичні нашарування у порожнинах серця. За потреби діагноз можна підтвердити магнітно- резонансним дослідженням серця. За наявності вираженої периферичної еозинофілії крові, ендоміокардіальна біопсія, як правило, не потрібна. Іноді ознаки серцевої недостатності можуть бути першим проявом ГЕС, через що, побачивши типову для гіпереозинофільного ураження серця ехо-картину, слід перевірити загальний аналіз крові. Правильна діагностика гіпереозинофільного ендоміокардіального фіброзу та призначення адекватного лікування дозволяють запобігти прогресуванню серцевої недостатності та розвитку ускладнень.
1. Виговська Я.І., Мазурок А.А., Масляк З.В. та ін. Диференціальна діагностика еозинофілій // Укр. мед. часопис. — 2002. — № 2. — С. 97-101.
2. Ommen S.R., Seward J.B., Tajik A.J. Clinical and echocardiographic features of hypereosinophilic syndromes // Am. J. Card. — 2000. — V. 83. — P. 110-113.
3. Benezet-Mazuecos J., de la Fuente A., Marcos-Alberca P., Farre J. Loeffler endocarditis: what have we learned? // Am. J. Hematol. — 2007. — V. 82. — P. 861-862.
4. Cincin A.A., Ozben B., Tanrikulu M.A. et al. Large apical thrombus in a patient with persistent heart failure and hypereosinophilia: Loffler endocarditis // J. Gen. Intern. Med. — 2008. — V. 10. — P. 1713-1718.
5. Debl K., Djavidani B., Buchner S. Time course of eosinophilic myocarditis visualized by CMR // J. Cardiovasc. Magn. Reson. — 2008. — V. 10. — P. 21.
6. Loffler W. Endocarditis parietalis fibroplastica mit Bluteosinophilie. Ein eigenartiges Krankheitsbild // Schweiz. Med. Wochenschr. — 1936. — B. 66. — S. 817-820.
7. Hardy W.R., Anderson R.E. The hypereosinophilic syndromes // Ann. Intern. Med. — 1968. — V. 68. — P. 1220-1229.
8. Chusid M.J., Dale D.C., West B.C., Wolff S.M. The hypereosinophilic syndrome: analysis of fourteen cases with review of the literature // Medicine (Baltimore). — 1975. — V. 54. — P. 1-27.
9. Tefferi A., Patnaik M.M., Pardanani A. Eosinophilia: secondary, clonal and idiopathic // Br. J. Haematol. — 2006. — V. 133. — P. 468-492.
10. Klion A.D., Bochner B.S., Gleich G.J. et al. on behalf of the Hypereosinophilic Syndromes Working Group. Approaches to the treatment of hypereosinophilic syndromes: a workshop summary report // J. Allergy Clin. Immunol. — 2006. — V. 117. — P. 1292-1302.
11. Roufosse F.E., Goldman M., Cogan E. Hypereosinophilic syndromes // Orphanet J. Rare Dis. — 2007. — V. 11. — P. 37.
12. Pereira N.L., Dec W. Restrictive and infiltrative cardiomyopathies // Cardiology / Ed. by M.H. Crawford, J.P. DiMarco, W.J. Paulus — 2nd ed. — Mosby, 2004. — P. 983-992.
13. Otto C.M. Textbook of clinical echocardiography. — 3rd ed. — Elsevier Saunders, 2004. — P. 241.
14. Carnero-Alcazar M., Requillo-Lacruz F., O’Connor F., Rodriguez-Hernandez E. Hypereosinophilic syndrome and myocardial fibrosis // Interact. Cardiovasc. Thorac. Surg. — 2008. — V. 7. — P. 928-930.
14. Gudmundsson G.S., Ohr J., Leva F. et al. An unusual case of recurrent Loffler endomyocarditis of the aortic valve // Arch. Pathol. Lab. Med. — 2003. — V. 127. — P. 606-609.
15. Ogbogu P.U., Rosing D.R., Horne M.K. III. Cardiovascular manifestations of hypereosinophilic syndromes // Immunol. Allergy Clin. North Am. — 2007. — V. 27. — P. 457-475.
