Международный неврологический журнал №6 (108), 2019
Вернуться к номеру
Влияние гравидарной антикоагулянтной и антиагрегантной терапии на клинику и исходы перивентрикулярных кровоизлияний у новорожденных
Авторы: Гайнетдинова Д.Д. (1), Каримова Л.К. (2)
1 - ФГБОУ ВО «Казанский государственный медицинский университет» Минздрава России, г. Казань, Республика Татарстан, РФ
2 - ГАУЗ «Детская республиканская клиническая больница» Министерства здравоохранения Республики Татарстан, г. Казань, Республика Татарстан, РФ
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
Актуальність. Великий перивентрикулярний крововилив (ПВК) (> 5 мм) є одним із тяжких станів новонароджених, що призводять до серйозних неврологічних наслідків. На цей час відсутні дані про вплив протизгортальної терапії (ПЗТ) під час вагітності на особливості перебігу ПВК у новонароджених. Мета дослідження: встановити особливості ПВК у новонароджених, які народилися від вагітностей на тлі антиагрегантної та антикоагулянтної терапії з приводу гіперкоагуляційного синдрому (ГКС). Матеріали та методи. Обстежено 112 новонароджених із ПВК: I група — 37 дітей, які народилися від вагітності на тлі ГКС і ПЗТ; II група — 55 дітей — від вагітності без ГКС на фоні превентивної ПЗТ; III група — 20 дітей — від вагітності, що мала перебіг без ГКС і ПЗТ. Усім новонародженим проводили клініко-неврологічний огляд із застосуванням шкал оцінки м’язово-постурального тонусу (INFANIB) і нервово-психічного розвитку (Гріффітс), а також нейросонографічне дослідження. Результати. Прийом ПЗТ матерями новонароджених I і II груп супроводжувався більш тяжким станом новонароджених із ПВК при народженні (вірогідно триваліше потребували штучної вентиляції легенів, частіше народжуються недоношеними, більший розмір гематом) порівняно з дітьми III групи. Катамнестичне спостереження за дітьми I і II груп показало більш повільну динаміку м’язово-постурального тонусу, параметрів нервово-психічного розвитку і зниження темпів психомоторного розвитку в дітей порівняно з дітьми III групи. Висновки. Корекція ГКС ПЗТ під час вагітності значимо впливає на тяжкість стану новонароджених при народженні, а також на формування грубої неврологічної симптоматики у подальшому.
Актуальность. Крупное перивентрикулярное кровоизлияние (ПВК) (> 5 мм) является одним из тяжелых состояний новорожденных, приводящих к серьезным неврологическим последствиям. В настоящее время отсутствуют данные о влиянии противосвертывающей терапии (ПСТ) во время беременности на особенности течения ПВК у новорожденных. Цель исследования: установить особенности ПВК у новорожденных, родившихся от беременностей на фоне антиагрегантной и антикоагулянтной терапии по поводу гиперкоагуляционного синдрома (ГКС). Материалы и методы. Обследовано 112 новорожденных с ПВК: I группа — 37 детей, родившихся от беременности на фоне ГКС и ПСТ; II группа — 55 детей — от беременности без ГКС на фоне превентивной ПСТ; III группа — 20 детей — от беременности, протекавшей без ГКС и ПСТ. Всем новорожденным проводили клинико-неврологический осмотр с применением шкал оценки мышечно-постурального тонуса (INFANIB) и нервно-психического развития (Гриффитс), а также нейросонографическое исследование. Результаты. Прием ПСТ матерями новорожденных I и II групп сопровождался более тяжелым состоянием новорожденных с ПВК при рождении (достоверно длительнее нуждались в ИВЛ, чаще рождались недоношенными, больший размер гематом) по сравнению с детьми III группы. Катамнестическое наблюдение за детьми I и II групп показало более медленную динамику мышечно-постурального тонуса, параметров нервно-психического развития и снижение темпов психомоторного развития у детей по сравнению с детьми III группы. Выводы. Коррекция ГКС ПСТ во время беременности значимо влияет на тяжесть состояния новорожденных при рождении, а также на формирование грубой неврологической симптоматики в последующем.
Background. Massive periventricular hemorrhages (PVH) (> 5 mm) is one of the most severe conditions in newborns, leading to adverse neurologic outcomes. At present, there is a lack of data on the influence of anticoagulation therapy during pregnancy on the clinical characteristics of newborns. The purpose of the study was to evaluate the features of PVH in neonates born to mothers receiving antiplatelet and anticoagulation therapy for hypercoagulation syndrome during pregnancy. Materials and methods. One hundred and twelve newborns with PVH were examined: group I — 37 children, born after a pregnancy with hypercoagulation syndrome and antithrombotic therapy; group II — 55 babies, born after a pregnancy without hypercoagulation syndrome and with preventive antithrombotic therapy; group III —
20 children, born after a pregnancy without hypercoagulation syndrome and without antithrombotic therapy. All newborns underwent clinical and neurologic examination using INFANIB and Griffiths scales and intracranial ultrasound evaluation. Results. Maternal anticoagulation therapy during pregnancy in groups I and II was associated with more severe condition of newborns with PVH (significantly prolonged artificial lung ventilation, more premature births, larger hemorrhage) compared to newborns in group III. Follow-up of infants in groups I and II demonstrated a significantly slower progress of postural muscle tone, neuropsychological and psychomotor development compared to infants in group III. Conclusions. Antithrombotic therapy for hypercoagulation syndrome during pregnancy significantly affects the severity of neonates’ condition at birth and the development of severe neurological impairments in long-term period.
гіперкоагуляційний синдром; новонароджений; перивентрикулярний крововилив; протизгортальна терапія
гиперкоагуляционный синдром; новорожденный; перивентрикулярное кровоизлияние; противосвертывающая терапия
hypercoagulation syndrome; newborn; periventricular hemorrhage; anticoagulation therapy
Введение
Беременность связана со значительными изменениями многих аспектов гемостаза (усиление кроветворения, увеличение объема плазмы в 3 раза, увеличение количества эритроцитов, снижение уровня гемоглобина и гематокрита и др.). Появление маточно–плацентарного круга кровообращения приводит к физиологической гиперкоагуляции, представляющей собой адаптацию к отделению плаценты в процессе родов. Во время беременности в организме женщины создаются условия, способствующие развитию синдрома диссеминированного внутрисосудистого свертывания крови (стаз крови, гиперкоагуляция), что выражается повышением суммарной активности факторов свертывания (общий коагулянтный потенциал) и функциональной активности тромбоцитов, а также снижением фибринолитической активности и активности антитромбина III. Все вышеперечисленные изменения являются компенсаторно–приспособительными для нормального формирования фетоплацентарного комплекса и ограничения кровопотери из плацентарной площадки после отделения плаценты [1–3].
При некоторых беременностях вследствие наличия антифосфолипидного синдрома, генетических дефектов гемостаза (мутации фактора V — Leiden, фермента метилентетрагидрофолатредуктазы — MTHFR, протромбина — Pt G20210А, ингибитора активатора плазминогена–1 — PAI–1, а также факторов II и VII), тромботических микроангиопатиях, гестационном диабете развивается патологическая гиперкоагуляция — гиперкоагуляционный синдром (ГКС) [4]. При отсутствии коррекции ГКС приводит к различным акушерским осложнениям, самыми грозными из которых являются преждевременные роды и внутриутробная гибель плода [5], а также развитие кровоизлияний, которые оказывают значимое влияние на последующее развитие детей и часто приводят к детскому церебральному параличу (ДЦП) и эпилепсии [6]. Критериями патологического ГКС является повышение уровней фибриногена более 6,5 г/л и D–димера более 1,7 мг/л [7]: свертывающая способность крови увеличивается, нарушается фетоплацентарный кровоток, развивается гипоксия тканей плода, прежде всего, головного мозга, что приводит в последующем к грубой неврологической патологии у ребенка. Применение антиагрегантов (предупреждают агрегацию тромбоцитов) и антикоагулянтов прямого действия (действуют на факторы свертывания крови), использующихся для коррекции патологического ГКС, существенно снижает количество тромботических осложнений у беременных. Имеются сведения о безопасности этих препаратов для плода — некоторые авторы отмечают отсутствие интранатальных осложнений у новорожденных в постнатальном периоде [8]. Однако исследований состояния новорожденных, родившихся от беременностей на фоне антиагрегантной терапии, в литературе мы не встретили. В то же время в практике неонатологов и детских неврологов часто встречаются новорожденные с кровоизлияниями, матери которых принимали антиагрегантную терапию во время беременности [9]. В связи с этим вполне закономерно возникает вопрос: повышается ли риск формирования внутричерепных кровоизлияний у новорожденных, родившихся от беременности на фоне антиагрегантой терапии ГКС? Наиболее часто диагностируемыми внутричерепными гематомами у новорожденных являются перивентрикулярные кровоизлияния (ПВК), прежде всего вследствие доступной нейровизуализации перивентрикулярной области головного мозга ребенка через большой родничок (нейросонография — НСГ) [10, 11]. ПВК 5 мм и более представляет собой тяжелейшее состояние новорожденных, часто приводящее к смертельному исходу и инвалидизации, тогда как ПВК менее 5 мм часто протекает субклинически, с хорошим восстановлением ребенка [12].
Основными факторами риска ПВК являются искусственное оплодотворение, недоношенность, низкий балл по шкале Апгар, проведение сердечно–легочной реанимации новорожденного [13]. Осложнения в течение беременности, такие как гестоз, преэклампсия, гиперкоагуляционный синдром и прием беременной женщиной антиагрегантных препаратов, также могут быть факторами риска ПВК [12].
Все вышеизложенное определило цель исследования: изучить влияние антиагрегантной терапии во время беременности на течение и исходы ПВК у новорожденных.
Материалы и методы
Проведенное исследование одобрено этическим комитетом Казанского государственного медицинского университета. От родителей всех детей, включенных в исследование, было получено информированное согласие.
Обследовано 112 новорожденных детей в возрасте от 1 до 15 дней жизни с ПВК ≥ 5 мм по данным НСГ на 3–7–й день жизни. Все дети распределены на 3 группы: I группа — 37 (33,0 %) детей (16 (43,2 %) девочек и 21 (56,8 %) мальчик), родившихся от беременности на фоне подтвержденного ГКС и антиагрегантной терапии; II группа — 55 (49,1 %) детей (36 (65,5 %) девочек и 19 (34,5 %) мальчиков), родившихся от беременности без ГКС, но протекавшей на фоне антиагрегантной превентивной терапии с целью «профилактики» нарушения маточно–плацентарного кровотока и гипоксии плода; III группа — 20 (17,9 %) детей, родившихся от беременности, протекавшей без ГКС и без антиагрегантной терапии (группа сравнения) (11 (55,0 %) девочек и 9 (45,0 %) мальчиков).
Критерии включения в I группу исследования: наличие у матери новорожденного ГКС во время настоящей беременности — повышенный уровень фибриногена > 6,5 г/л и D–димера > 1,7 мг/л [7], наличие указаний на прием антиагрегантных препаратов в течение 1 недели и более до родов.
Критерии включения во II группу исследования: отсутствие у матери новорожденного ГКС во время настоящей беременности [7], наличие нарушений маточно–плацентарного кровотока Iа степени при проведении допплерометрии, указания на прием антиагрегантных препаратов в течение 1 недели и более до родов.
Критерии включения в III группу исследования: отсутствие у матери новорожденного ГКС во время настоящей беременности [7] и отсутствие указаний на прием антиагрегантных препаратов во время беременности.
Критерии исключения из исследования: ПВК< 5 мм по данным НСГ; ПВК инфекционного и травматического генеза; возраст новорожденного > 16 дней; наличие генетических заболеваний.
Использованы анамнестический, клинико–неврологический метод, метод лучевой диагностики (нейросонография), статистический метод. Сведения о состоянии здоровья детей при рождении, данные соматического и акушерского анамнеза матерей были получены из сопровождающей новорожденного медицинской документации при переводе из родильного дома в отделение патологии новорожденных и недоношенных детей Детской республиканской клинической больницы МЗ РТ (г. Казань). При сборе анамнестических данных изучены: возраст матери; порядковый номер беременности и родов; исходы предыдущих беременностей; длительность ожидания наступления беременности; способ зачатия; наличие хронических заболеваний у матери; особенности течения беременности; прием лекарственных препаратов во время беременности; наличие преэклампсии; срок родов и способ родоразрешения. Клинико–неврологический метод включал стандартный осмотр ребенка по общепринятой схеме с применением шкал: Журбы — Мастюковой, Гриффитс и INFANIB. При нейросонографии оценивались макроструктура головного мозга, четкость рисунка борозд, гидрофильность тканей, состояние межполушарной борозды, субарахноидального пространства, полости прозрачной перегородки и полости Верге, передних и задних рогов боковых желудочков, тело боковых желудочков, третьего и четвертого желудочков, задней цистерны, контуры сосудистых сплетений, стволовых структур, перивентрикулярных и субвентрикулярных зон, индекс резистентности. Статистическая обработка результатов исследования проводилась с использованием Microsoft Excel и статистического программного обеспечения «Биостат» (Издательский дом «Практика», 2006), SPSS 15.0 и Statistica 8.0 for Windows (StatSoft Inc., США). Различия считались статистически значимыми при уровне ошибки p < 0,05.
Результаты
Матери I и II групп принимали комбинированную терапию — дипиридамол (25 мг 3 раза в день) и ацетилсалициловую кислоту (25 мг 1 раз на ночь). До 1 месяца до родов антиагрегантную терапию принимали 7 (18,9 %) женщин I группы и 32 (58,2 %) II группы, а более 1 месяца до родов — 30 (81,1 %) и 23 (41,8 %) женщин соответственно.
Срок гестации при рождении у детей I группы составил 33,7 ± 3,4 недели, II группы — 34,8 ± 3,7 недели и III группы был значимо выше, чем в I и II группах, — 37,8 ± 7,0 недели (p < 0,05). В III группе доношенными родились 12 (60,0 %) детей, тогда как в I и II группах — лишь 4 (10,8 %) и 14 (25,5 %) детей соответственно, что в 5,56 и 2,35 раза меньше, чем в группе сравнения (p < 0,05).
Дети II группы, матерям которых была назначена антиагрегантная терапия в «профилактических целях», так же часто, как и дети I группы, родились преждевременно: 74,6 и 89,1 % соответственно, тогда как дети, матери которых не принимали соответствующую терапию, родились преждевременно значимо реже (49,0 %).
Сразу после рождения по тяжести состояния на аппарате ИВЛ находилось 46 (41,2 %) новорожденных с ПВК I и II групп, при этом в проведении ИВЛ нуждалось достоверно большее число детей II группы (58,2 %), чем I (37,8 %) (p < 0,05). Ни один ребенок III группы не нуждался в проведе–нии ИВЛ.
Выявлены статистически значимые различия по длительности нахождения на ИВЛ новорожденных I и II групп (табл. 1). Большинство новорожденных II группы нуждалось в проведении ИВЛ менее 3 суток (56,5 %), тогда как новорожденные I группы достоверно чаще, чем малыши II группы, находились на ИВЛ более 7 суток (60,9 и 4,3 % соответственно; p < 0,001). Ни один ребенок II группы не нуждался в ИВЛ более 15 суток, тогда как 17,4 % детей I группы находились на ИВЛ более 15 суток. В среднем детиI группы нуждались в ИВЛ в 2 раза дольше, чем новорожденные II группы: 8,0 ± 6,2 дня и 3,8 ± 2,3 дня соответственно; p < 0,05.
По данным НСГ у новорожденных I и II групп визуализированы преимущественно двусторонние перивентрикулярные гематомы, практически с одинаковой частотой у 27 (73,0 %) детей в I группе и 39 (70,9 %) во II группе, тогда как в III группе двусторонние гематомы диагностированы лишь у 1 ребенка (5,0 %).
Односторонняя локализация ПВК обнаружена у 10 (27,0 %) детей I группы, у 16 (29,1 %) детей II группы и почти у всех новорожденных (n = 19; 95,0 %)III группы. Из односторонне локализованных ПВК в I группе чаще формировались левосторонние гематомы (16,2 %), во II группе — правосторонние (20,0 %), в III группе справа и слева диагностированы примерно поровну.
В I группе у детей, рожденных в срок (38–40 недель), средние размеры правосторонних гематом были достоверно меньше, чем у доношенных детей II группы (5,44 ± 0,44 мм и 6,23 ± 0,60 мм соответственно; p < 0,05). У детей, родившихся на сроке гестации менее 29 недель в I группе размеры гематом оказались значимо больше и справа, и слева (справа — 8,60 ± 2,89 мм и слева — 8,70 ± 2,95 мм), чем у пациентов II группы (справа — 6,00 ± 1,02 мм и слева — 6,00 ± 1,41 мм) (p < 0,05), а у новорожденных III группы того же срока гестации размеры гематом были достоверно меньше, чем в I и II группах, и справа, и слева (p < 0,05).
Размеры гематом у детей, родившихся без гравидарной антиагрегантной терапии (III группа), меньше, чем у новорожденных, родившихся от беременностей на фоне антиагрегантной терапии.
Достоверно значимые различия получены у доношенных детей всех трех групп, при этом наибольшими оказались гематомы во II группе. У детей, родившихся раньше срока (< 38 недель), средние размеры гематом увеличиваются со снижением срока гестации при рождении, при этом средние размеры ПВК в I группе больше значений во II и, особенно, в III группах. Корреляционный анализ длительности приема антиагрегантной терапии с размерами гематом выявил положительную корреляционную взаимосвязь в I (r = 0,571; p < 0,05) и II (r = 0,426; p < 0,05) группах. Полученные данные подчеркивают значимое влияние антиагрегантной терапии на размеры гематом у новорожденных. При этом размеры гематом как справа, так и слева были значимо больше у новорожденных I группы в сравнении с показателями детей II группы.
Неврологическое наблюдение за детьми осуществляли в течение 1 года. Все дети, включенные в исследование, получали лечение в соответствии со стандартами оказания медицинской помощи. Оценку психоневрологического развития детей проводили в соответствии с нормами для скорригированного возраста.
В 1–й месяц скорригированного возраста неврологическая симптоматика отсутствовала у 65,0 % детей III, 16,4 % — II и лишь у 5,4 % — I группы(p < 0,05). Неврологические синдромы преимущественно выявлены у детей I группы в виде диффузной мышечной гипотонии (73,0 %), гипертензионного синдрома (24,3 %), пирамидного синдрома (21,6 %), задержки моторного и психоречевого развития (54,1 и 24,3 %). Во II группе эти синдромы наблюдались достоверно реже: у 47,2; 9,1; 36,4; 32,7; 7,3 % соответственно. В III группе отмечены лишь пирамидный синдром у 15,0 % детей и диффузная мышечная гипотония у 20,0 %.
Клинико–неврологический осмотр детей в 6 месяцев скорригированного возраста не выявил неврологической симптоматики уже у 80,0 % пациентов III группы, у 21,8 % — II и лишь у 16,2 % I группы(p < 0,05). Неврологическое неблагополучие у детейI группы проявлялось у более чем половины обследованных с пирамидным синдромом (64,9 %), задержкой моторного развития (54,1 %), а также сочетанием двух и более синдромов (56,8 %). У детей II группы перечисленные синдромы выявлены также чаще других, но реже, чем в I группе (p > 0,05). В III группе выявлены лишь пирамидный синдром и диффузная мышечная гипотония (по 2 ребенка — 10,0 %). Очаговая неврологическая симптоматика в виде гемипареза сформировалась у 8,1 % (n = 3) детей I группы (правосторонний у 2 детей и у 1 — левосторонний) и 3,6 % (n = 2) II группы (1 левосторонний и 1 правосторонний) и не выявлена в III группе.
На фоне регулярно проводимых комплексных реабилитационных/абилитационных мероприятий оценка неврологического статуса в 12–месячном скорригированном возрасте выявила динамику неврологической симптоматики у обследованных детей. Так, без патологии нервной системы годовалого возраста достигли уже 21,6 % (n = 8) детей I группы; 38,2 % (n = 21) — II группы и 90,0 % (n = 18) —III группы. При исследовании нарушений мышечного тонуса обнаружено, что пирамидный синдром чаще всего наблюдался у детей I группы (54,1 %), несколько реже — во II (43,6 %) и III группах (10 %; p < 0,05). Диффузная мышечная гипотония диагностирована у 5,4 % детей I группы и 10,9 % II, а у малышей III группы не наблюдалась вовсе. Двигательный дефицит в виде гемипареза сформировался у 8,1 и 3,6 % детей I и II групп, спастическая диплегия и тетрапарез — у 10,8 % детей I группы. Задержка моторного и психоречевого развития наблюдалась у 43,2 и 8,1 % детей I группы и 16,4 и 1,8 % детейII группы.
Детский церебральный паралич в исходе ПВК сформировался у 7 (18,9 %) детей I группы, у 2 (3,6 %) детей II и ни у одного ребенка из III группы. Все дети с ДЦП в исходе ПВК к 1–му году (n = 9) как в I (3 ребенка с гемипарезом, 2 — со спастической диплегией и 2 — со спастическим тетрапарезом), так и во II (2 ребенка с гемипарезом) группах родились недоношенными оперативным родоразрешением. В I группе 3 ребенка родились на сроке < 29 недель и 4 — на сроке 29–31 неделя, а во II — 1 девочка на сроке < 29 недель, 1 мальчик на сроке 29–31 недель. Все дети с ДЦП в исходе ПВК нуждались в ИВЛ сразу после рождения: пациенты I группы находились на ИВЛ от 11 до 17 суток, II — от 5 до 12 суток. Длительность антиагрегантной терапии составила от 2 до 8 месяцев до родов: у 4 и 2 детей I и II групп соответственно, у 3 детей I группы — все 9 месяцев. Нейросонографическое исследование в неонатальном возрасте выявило двустороннюю локализацию гематом у всех детей с ДЦП (средний размер гематом 6,72 ± 0,18 мм) (табл. 2).
Оценка мышечно–постурального тонуса по шкале INFANIB выявила значимые различия между исследуемыми группами. К 6–му месяцу жизни мышечно–постуральный тонус был физиологическим у 80,0 % детей III группы (< 54 баллов) и лишь у 16,2 % (n = 6) детей I группы и 21,8 % (n = 12) II группы (p < 0,05). Патология мышечно–постурального тонуса (> 72 баллов) значимо чаще наблюдалась у детей I и II групп как в 6–месячном возрасте (64,9 и 58,2 %; p < 0,05), так и в 12–месячном скорригированном возрасте (54,1 и 40,0 % соответственно). Таким образом, темпы нормализации мышечно–постурального тонуса и двигательных функций, оцененные по шкале INFANIB, у детей, матери которых принимали антиагрегантную терапию как с целью коррекции ГКС, так и для «профилактики» нарушения маточно–плацентарного кровотока, были достоверно ниже по сравнению с детьми, в анамнезе матерей которых отсутствовало упоминание о приеме антиагрегантных препаратов. Полученные данные свидетельствуют о том, что прием антиагрегантной терапии может негативно влиять на мышечно–постуральный тонус в течение первого года жизни детей с ПВК.
У детей с грубой неврологической симптоматикой I и II групп (n = 9) динамика оценок по шкале INFANIB носила неравномерный характер с периодами отрицательной динамики в интервале от 6–го до 9–го месяца за счет формирующихся с возрастом двигательных нарушений, задержки редукции тонических рефлексов и спинальных автоматизмов, и к 12 месяцам скорригированного возраста баллы соответствовали диапазону «патология».
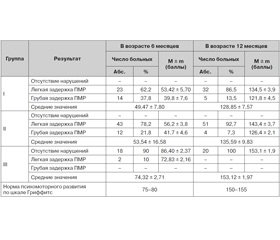
Оценка психомоторного развития (ПМР) по шкале Гриффитс обнаружила различия (p < 0,05) данных между I и III, а также II и III группами детей в возрасте 6 месяцев скорригированного возраста (табл. 3). У детей I и II групп средние значения психомоторного развития были существенно ниже нормы (49,47 ± 7,80 балла и 53,54 ± 16,58 балла соответственно), тогда как у детей группы сравнения в этом возрасте средние показатели были близкими к физиологическим (74,32 ± 2,71 балла). В 12–месячном возрасте средние показатели психомоторного развития существенно улучшились, но показатели в I и II группах все же не достигли нормальных значений.
Отсутствие задержки развития по шкале Гриффитс у детей III группы в возрасте 12 месяцев и наличие признаков легкой задержки психомоторного развития лишь у 10 % детей в возрасте 6 месяцев скорригированного возраста по сравнению с наличием как легкой, так и грубой психоневрологической симптоматики у детей I и II групп свидетельствует о влиянии антиагрегантной терапии в анамнезе на течение и исходы ПВК, что отражается в задержке психомоторного развития у детей, родившихся от беременностей на фоне антиагрегантной терапии.
Клинический пример
Женщина, 24 года, беременность 23 недели, на плановом ультразвуковом исследовании плода с допплерометрией выявлено нарушение маточно–плацентарного кровотока Iа степени. Гемостазиограмма без патологии. Учитывая нарушения маточно–плацентарного кровотока, для «профилактики» гипоксии плода акушер–гинеколог назначил комбинированную терапию — дипиридамол (25 мг 3 разав день) и ацетилсалициловую кислоту (25 мг 1 раз на ночь). После 1 месяца приема препаратов проведена повторная допплерометрия — показатели без существенных изменений, рекомендовано продолжить прием. Через 2 месяца непрерывного приема антиагрегантной терапии на 31–й неделе беременности появилось вагинальное кровотечение. На УЗИ плода диагностирована частичная отслойка нормально расположенной плаценты, кардиотокография плода — признаки острой гипоксии (3 балла). Экстренное кесарево сечение, масса новорожденного 2450 г, состояние по Апгар 1–3 балла, ИВЛ в течение 5 суток. Нейросонография на 3–и сутки жизни новорожденного — макроструктура мозга мало дифференцирована, гидрофильность тканей умеренно повышена, рисунок извилин и борозд слабо выражен, полость прозрачной перегородки 5,9 мм, перивентрикулярно гематома справа 6,3 × 2,4 мм и слева 8,4 × 3,4 мм. В неврологическом статусе на 3–й день жизни ребенка уровень сознания (шкала оценки сознания у новорожденных Вольпе) — ступор средний, угнетение безусловных и сухожильных рефлексов. Проводится инфузионная, метаболическая терапия, лечение положением, тактильно–кинестетическая стимуляция ладоней и пальцев. На 9–е сутки жизни дыхание поддерживается увлажненным кислородом через колпак, питание через зонд, вялая реакция на осмотр, вздрагивания при прикосновении и в покое, гиперестезия кожных покровов, угнетение сухожильных и безусловных рефлексов. Проводится инфузионная и нейротрофическая терапия, стимуляция орофациальных рефлексов, лечебная физкультура и общий массаж с 14–го дня жизни. Выписан из стационара на 22–й день жизни: дыхание самостоятельное, питание per os (из соски), взгляд фиксирует, черепные нервы без асимметрии, мышечный тонус диффузно снижен, сухожильные рефлексы живые, равные. Спинальные и позотонические безусловные рефлексы снижены. На НСГ визуализируются субвентрикулярные кисты справа 5,4 × 3,2 мм и слева 7,4 × 4,0 мм.
Дальнейшее неврологическое наблюдение за ребенком осуществляли в течение года с учетом корригированного возраста. В 1–й месяц жизни в неврологическом статусе выявлены: пирамидный синдром, транзиторное нарушение функций (по шкале оценки мышечно–постурального тонуса INFANIB52 балла), легкие нарушения психомоторного развития (по шкале Гриффитс 4 балла). По данным НСГ: субвентрикулярная киста справа 2,3 мм и слева4,5 мм. В условиях круглосуточного стационара проведены нейротрофическая терапия, назначены витамины группы В, общий избирательный массаж, лечебная физкультура, теплолечение, физиотерапия, сухая иммерсия. В 6–месячном возрасте неврологический осмотр выявил очаговую неврологическую симптоматику (правосторонний гемипарез), нарушения мышечно–постурального тонуса (по шкале INFANIB 34 балла — гемипарез), задержку психомоторного развития — не переворачивается, не захватывает и не удерживает игрушку правой рукой, в позиции на животе на правую руку не опирается, не гулит (по шкале Гриффитс 38 баллов). При проведении НСГ патологических изменений со стороны визуализируемых участков головного мозга не выявлено. Проведены лечение и реабилитация в условиях отделения медицинской реабилитации пациентов с нарушением функции ЦНС: ноотропная и сосудистая терапия, гидрокинезотерапия, общий избирательный массаж, физиотерапия, индивидуальная кинезотерапия, фитболтерапия, эрготерапия, постуральный тренинг.
В 12–месячном возрасте отмечена положительная динамика психомоторного развития (по шкале Гриффитс 38 → 125 баллов) и мышечно–постурального тонуса (по шкале INFANIB 34 → 58 баллов), гемипарез сохраняется. Диагностирован детский церебральный паралич, гемипаретическая форма.
Обсуждение
Исследование показало, что дети с ПВК, родившиеся у матерей с гравидарной антиагрегантной терапией, чаще рождаются недоношенными по сравнению с детьми с ПВК, матери которых не принимали антиагрегантные препараты. Важно отметить, что дети, родившиеся от беременности на фоне подтвержденного ГКС и антиагрегантной терапии, реже рождались недоношенными, чем дети, родившиеся от беременности без ГКС, но протекавшей на фоне антиагрегантной превентивной терапии с целью «профилактики» нарушения маточно–плацентарного кровотока и гипоксии плода. Кроме того, дети, матери которых принимали антиагрегантные препараты во время беременности, часто рождаются в тяжелом состоянии и нуждаются в проведении ИВЛ после рождения, причем дети, родившиеся от беременности на фоне подтвержденного ГКС и антиагрегантной терапии, нуждаются в ИВЛ в 2 раза дольше, чем дети, родившиеся от беременности без ГКС, но протекавшей на фоне антиагрегантной превентивной терапии с целью «профилактики» нарушения маточно–плацентарного кровотока и гипоксии плода, чего не наблюдается у детей с ПВК, матери которых не принимали антиагрегантных препаратов. У детей с ПВК, родившихся от матерей, получающих антиагрегантную терапию как с целью коррекции ГКС, так и для «профилактики» гипоксии, чаще развиваются двусторонние кровоизлияния, тогда как при отсутствии антиагрегантной терапии — односторонние. Как правосторонние, так и левосторонние гематомы достоверно крупнее при наличии указаний на прием антиагрегантных препаратов, чем при их отсутствии. При этом размеры ПВК у детей, родившихся в срок < 29 недель, в группе детей, родившихся от беременности на фоне подтвержденного ГКС и антиагрегантной терапии, больше, чем в группе детей, родившихся от беременности без ГКС, но протекавшей на фоне антиагрегантной превентивной терапии с целью «профилактики» нарушения маточно–плацентарного кровотока и гипоксии плода. Результаты катамнестического наблюдения за детьми, матери которых получали антиагрегантную терапию во время беременности либо для коррекции ГКС, либо с целью «профилактики» гипоксии плода, показали более медленную динамику мышечно–постурального тонуса и динамику параметров нервно–психического развития на протяжении первых 12 месяцев скорригированного возраста по сравнению с детьми, матери которых не принимали соответствующую терапию. Неврологическое наблюдение в течение 1 года продемонстрировало достоверно более частое формирование детского церебрального паралича, различных неврологических синдромов и снижение темпов психомоторного развития у детей, матери которых получали антиагрегантную терапию как по поводу ГКС, так и с целью «профилактики» гипоксии плода, чем у детей, матери которых не принимали антиагрегантную терапию во время беременности.
Проведенное исследование показало, что назначение антиагрегантной терапии матерям во время беременности как в целях коррекции ГКС, так и «профилактики» гипоксии не безразлично для новорожденного и оказывает значимое влияние на тяжесть состояния ребенка при рождении, формирование крупных перивентрикулярных гематом, а также формирование ДЦП и грубой неврологической симптоматики к 12 месяцам скорригированного возраста, в связи с чем назначение беременным группы риска антиагрегантной терапии должно быть крайне обоснованным, а последующее ведение новорожденных с ПВК особенно внимательным. Полученные в ходе данной работы результаты диктуют необходимость дальнейшего изучения особенностей течения, диагностики, коррекции и совершенствования алгоритмов катамнестического ведения детей, родившихся с ПВК, в целях разработки абилитационных мероприятий и профилактики детской инвалидности.
Выводы
1. Гравидарная антиагрегантная терапия у беременной женщины является фактором риска преждевременного рождения ребенка и формирования двусторонних перивентрикулярных кровоиз–лияний.
2. Гравидарная антиагрегантная терапия, назначенная как для коррекции патологического ГКС, так и в целях «профилактики» нарушения маточно–плацентарного кровотока и гипоксии плода (без ГКС), значимо влияет на тяжесть состояния ребенка при рождении и неврологические исходы ПВК у детей.
3. Полученные в ходе данной работы результаты диктуют необходимость дальнейшего изучения особенностей течения, диагностики, коррекции и совершенствования алгоритмов катамнестического ведения детей, родившихся с ПВК, в целях разработки абилитационных мероприятий и профилактики детской инвалидности.
Конфликт интересов. Авторы заявляют об отсутствии какого–либо конфликта интересов и собственной финансовой заинтересованности при подготовке данной статьи.
Статья впервые опубликована в «Журнале неврологии и психиатрии имени С.С. Корсакова», т. 118, № 5, 2018, с. 38–45Разрешение от авторов и от редакции журнала на перепечатку статьи получено
1. Макацария А.Д., Бицадзе В.О., Мищенко А.Л. Нарушения гемостаза и массивные послеродовые кровотечения. Акушерство, гинекология и репродукция. 2014. 8(2). 17–26. [Makatsariya A.D., Bitsadze V.O., Mishenko A.L. Hemostasis abnormalities and massive obstetric bleeding. Akusherstvo, ginekologija i reprodukcija. 2014. 8(2). 17–26. (In Russ.)]
2. Медянникова И.В. Гемостазиологический контроль при беременности. Клиницист. 2014. 1. 47–52. [Medyannikova I.V. Hemostasiological monitoring during pregnancy. Klinicist. 2014. 1. 47–52. (In Russ.)]
3. Chauleur C., Raia T., Gris J.C. Antithrombotictherapy and pregnancy. Presse Med. 2013. 42(9). 1251–8. https://doi.org/10.1016/j.lpm.2013.06.003.
4. Буйлова Е.В., Котовщикова Е.Ф., Сюльжина Е.Н., Акимцева Е.А., Дугенец Г.В., Чудимов В.Ф. Частота встречаемости генетических дефектов системы гемостаза у пациентов с дисплазией соединительной ткани и признаками венозной дисфункции церебральных сосудов. Фундаментальные исследования. 2013. 12–1. 27–29. [Вuylova E.V., Kotovschikova E.F., Syulzhina E.N., Аkimseva E.A., Dugenes G.V., Chudimov V.F. Occurrence of genetic defects of hemostasis system at patients with connective tissue dysplasia against a cerebral venous dysfunction. Fundamental'nye issledovanija. 2013. 12–1. 27–29. (In Russ.)]
5. James A.H. Thrombosis in pregnancy and maternal outcomes. Birth. Defects Res. C. Embryo Today. 2015. 105(3). 159–66. https://doi.org/10.1002/bdrc.21106.
6. Kaffashian S., Tzourio C., Zhu Y.C., Mazoyer B., Debette S. Differential Effect of White–Matter Lesions and Covert Brain Infarcts on the Risk of Ischemic Stroke and Intracerebral Hemorrhage. Stroke. 2016. 47(7). 1923–5 https://doi.org/10.1161/STROKEAHA.116.012734.
7. Сидельникова В.М., Кирюшников П.А. Гемостаз и беременность. М.: Триада X, 2004. 208. [Sidel'nikova V.M., Kirjushnikov P.A. Gemostaz i beremennost'. M.: Triada X, 2004. 208. (In Russ.)]
8. Middeldorp S. Anticoagulation in pregnancy complications. Hematology Am. Soc. Hematol. Educ. Program. 2014. 2014(1). 393–9. https://doi.org/10.1182/asheducation–2014.1.393.
9. Гайнетдинова Д.Д., Каримова Л.К., Казакова Ф.М. Анализ факторов риска перивентрикулярных кровоизлияний у новорожденных, родившихся у женщин с гиперкоагуляционным синдромом. Практическая медицина. 2016. 7(99). 31–36. [Gaynetdinova D.D., Karimova L.K., Kazakova F.M. Assessment of risk factors of periventricular hemorrhage in newborns of women with hypercoagulation syndrome. Prakticheskaja medicina. 2016. 7(99). 31–36. (In Russ.)]
10. Дубасова Н.М., Александров Ю.А. Эхографическая диагностика субдурального кровоизлияния у новорожденного (клиническое наблюдение). Радиология — практика. 2015. 3. 48–53. [Dubasova N.M., Alexandrov Yu.A. Ultrasound Detection of Subdural Hemorrhage in a Newborn (Case Report). Radiologija — praktika. 2015. 3. 48–53. (In Russ.)]
11. Ольхова Е.Б., Дубасова Н.М. Преимущества полипозиционной нейросонографии в диагностике оболочечных кровоизлияний у детей раннего возраста. Радиология — практика. 2015. 5. 22–35. [Olkhova E.B., Dubasova N.M. The Advantages of Multiple View Cranial Ultrasonography in Detecting Extra–cerebral Intracranial Hemorrhages in Neonatesand Infants of the First Months of Life. Radiologija–praktika. 2015. 5. 22–35.
(In Russ.)]
12. Whitelaw A. Periventricular hemorrhage: a problem still today. Early Hum. Dev. 2012. 88(12). 965–9. https://doi.org/10.1016/j.earlhumdev.2012.09.004.
13. Payne A.H., Hintz S.R., Hibbs A.M., Walsh M.C., Vohr B.R., Bann C.M., Wilson–Costello D.E. Eunice Kennedy Shriver National Institute of Child Health and Human Development Neonatal Research Network. Neurodevelopmental outcomes of extremely low–gestational–age neonates with low–grade periventricular–intraventricular hemorrhage. JAMA. Pediatr. 2013. 167(5). 451–9. https://doi.org/10.1001/jamapediatrics.2013.866.

/12-m-1.jpg)
/14-m-1.jpg)
/15-m-1.jpg)