Международный неврологический журнал Том 16, №1, 2020
Вернуться к номеру
Зміна глікозильних детермінант імуноглобулінів у хворих на розсіяний склероз як діагностичний маркер захворювання
Авторы: Гичка К.М.
Львівський національний медичний університет імені Данила Галицького, м. Львів, Україна
Рубрики: Неврология
Разделы: Клинические исследования
Версия для печати
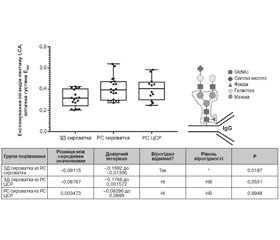
Метою роботи було дослідження аспектів змін глікозильних детермінант людини при розсіяному склерозі (РС), які раніше не досліджували. Було проведено дослідження глікозилювання антитіл у цереброспінальній рідині (ЦСР), порівняння з антитілами сироватки крові та визначення їх природи. А також виявлення специфічного для розсіяного склерозу класу автоантитіл, що може слугувати надійним біомаркером цього захворювання. Матеріали та методи. Проаналізовано 18 зразків сироватки крові здорових донорів (ЗД) та 20 зразків сироватки крові хворих на РС, із них 12 зразків ЦСР хворих на РС. Результати. Аналіз імунних комплексів молекул IgM, зв’язаних із молекулами IgG, показав значну різницю у їх вмісті між сироваткою ЗД та сироваткою пацієнтів із РС, у яких спостерігався вірогідно вищий вміст імунних комплексів IgG–IgM. Лектин-імуноферментний аналіз досліджуваних сироваток показав, що рівень експонування сіалових залишків, виявлений з лектином SNA, є вірогідно вищим у сироватках хворих на РС порівняно зі здоровими донорами. Також було відзначено зростання рівня експонування залишків фукози на імуноглобулінах як сироватки, так і ЦСР у хворих на РС порівняно зі здоровими донорами. При цьому рівень їх експонування на імуноглобулінах ЦСР був вірогідно вищим за такий в імуноглобулінах сироватки. Висновки. Рівень експонування фукозильних і сіалових залишків у сироватці та ЦСР у хворих на РС вірогідно різниться. Кількість детектованих молекул імуноглобулінів у всіх випадках була однаковою. У такий спосіб було показано, що в досліджуваних зразках сироваток та ЦСР хворих на РС відбуваються значні зміни експонування термінальних сіалових кислот і корових фукозильних залишків, які не пов’язані із зміною кількості самих N-гліканів чи появою додаткових сайтів глікозилювання на молекулах імуноглобулінів.
Целью работы было исследование аспектов изменений гликозильных детерминант человека при рассеянном склерозе (РС), которые ранее не исследовались. Было проведено исследование гликозилирования антител в цереброспинальной жидкости (ЦСЖ), сравнение с антителами сыворотки крови и определение их природы. А также выявление специфического для рассеянного склероза класса аутоантител, что может служить надежным биомаркером этого заболевания. Материалы и методы. Проанализированы 18 образцов сыворотки крови здоровых доноров (ЗД) и 20 образцов сыворотки крови больных РС, из них 12 образцов ЦСЖ больных РС. Результаты. Анализ иммунных комплексов молекул IgM, связанных с молекулами IgG, показал значительную разницу в их содержании между сывороткой ЗД и сывороткой пациентов с РС, у которых наблюдалось достоверно более высокое содержание иммунных комплексов IgG–IgM. Лектин-иммуноферментный анализ исследуемых сывороток показал, что уровень экспонирования сиаловых остатков, обнаруженных с лектином SNA, является достоверно более высоким в сыворотках больных РС по сравнению со здоровыми донорами. Также был отмечен рост уровня экспонирования остатков фукозы на иммуноглобулинах как сыворотки, так и ЦСЖ у больных РС по сравнению со здоровыми донорами. При этом уровень их экспонирования на иммуноглобулинах ЦСЖ был достоверно выше такового в иммуноглобулинах сыворотки. Выводы. Уровень экспонирования фукозильных и сиаловых остатков в сыворотке и ЦСЖ у больных РС достоверно различается. Количество детектированных молекул иммуноглобулинов во всех случаях было одинаковым. Таким образом было показано, что в исследуемых образцах сывороток и ЦСЖ больных РС происходят значительные изменения экспонирования терминальных сиаловых кислот и коревых фукозильных остатков, которые не связаны с изменением количества самих N-гликанов или появлением дополнительных сайтов гликозилирования на молекулах иммуноглобулинов.
Background. The study aimed to investigate the aspects of glycosyl determinants alteration in human with multiple sclerosis that have not been studied before. Materials and methods. Glycosylation of antibodies in cerebrospinal fluid (CSF) have been studied and compared with serum antibodies with the determination of their nature. The detection of multiple sclerosis (MS) specific autoantibodies can serve as a reliable biomarker for this disease. Eighteen samples of serum of healthy donors (HD) and 20 samples of serum of patients with MS were analysed, 12 of which were samples of CSF of patients with MS. Results. An analysis of the immune complexes of IgM molecules bound to IgG molecules revealed a significant difference in their content between the serum of HD and the serum of patients with MS who had slightly higher levels of IgG-IgM immune complexes. Lectin enzyme-linked immunosorbent analysis has shown that the level of exposure of sialic residues detected with SNA lectin was significantly higher in patients with MS compared to healthy donors. There was also an increase in the level of exposure of fucose residues to both serum and CSF immunoglobulins in MS patients compared to healthy donors. The level of their exposure to CSF immunoglobulins was significantly higher than a level in serum immunoglobulins. Conclusions. The level of exposure of fucosyl and sialyl residues to the serum and CSF in MS patients significantly differs. In all cases, the number of immunoglobulin molecules detected was the same. Thus, it was shown that in the tested samples of sera and CSF of the patients with MS, the exposure of terminal sialic acids and bark fucosyl residues significantly altered, which was not associated with changes in the number of N-glycans themselves or the appearance of additional glycosylation sites on immunoglobulins molecules.
глікозилювання; ліквор; розсіяний склероз; імуноглобуліни; біомаркер
гликозилирование; ликвор; рассеянный склероз; иммуноглобулины; биомаркер
glycosylation; cerebrospinal fluid; multiple sclerosis; immunoglobulins; biomarker
Вступ
Матеріали та методи
Результати та обговорення
Висновки
1. Lassmann H., Brück W., Lucchinetti C.F. The immunopathology of multiple sclerosis: anoverview. Brain Pathol. 2007. № 17. P. 210-8. doi: 10.1111/j.1750-3639.2007.00064.x.
2. Негрич Т.І., Євтушенко С.К., Сорокін Б.В., Москаленко М.А. Доказова база методів діагностики і лікування розсіяного склерозу. Міжнародний неврологічний журнал. 2012. № 5(51). С. 25-30.
3. Conway D., Cohen J.A. Emerging oral therapies in multiple sclerosis. Current neurology and neuroscience reports. 2010. Vol. 10. № 5. P. 381-388.
4. Compston A., Coles A. Multiple sclerosis. Lancet. 2002. Vol. 359. P. 1221-1231.
5. Baumann I., Kolowos W., Voll R.E. et al. Impaired uptake of apoptotic cells into tingible body macrophages in germinal centers of patients with systemic lupus erythematosus. Arthritis Rheum. 2002. № 46. Р. 191-201. Available from: http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=11817590.
6. Blauth K., Owens G.P., Bennett J.L. The Ins and Outs of B Cells in Multiple Sclerosis. Front. Immunol. 2015. № 6. Р. 1-7. Available from: http://journal.frontiersin.org/Article/10.3389/fimmu.2015.00565/abstract.
7. Fickentscher C., Magorivska I., Janko C. et al. The Pathogenicity of Anti-β 2GP1-IgG Autoantibodies Depends on Fc Glycosylation. J. Immunol. Res. 2015. № 2015. Р. 1-12. Available from: http://www.hindawi.com/journals/jir/2015/638129/.
8. Imafuku Y., Yoshida H., Yamada Y. Reactivity of agalactosyl IgG with rheumatoid factor. Clin. Chim. Acta. 2003. № 334. Р. 217-223.
9. Lin C.-W., Tsai M.-H., Li S.-T. et al. A common glycan structure on immunoglobulin G for enhancement of effector functions. Proc. Natl. Acad. Sci. 2015. № 112. Р. 10611-10616. Available from: http://www.pnas.org/lookup/doi/10.1073/pnas.1513456112.
10. Stümer J., Biermann M., Knopf J. et al. Altered glycan accessibility on native immunoglobulin G complexes in early rheumatoid arthritis and its changes during therapy. Clin. Exp. Immunol. 2017. № 189. Р. 372-382. Available from: http://www.ncbi.nlm.nih.gov/pubmed/28509333.
11. Sjöwall C., Zapf J., von Löhneysen S. et al. Altered glycosylation of complexed native IgG molecules is associated with disease activity of systemic lupus erythematosus. Lupus. 2015. № 24. 569-581. Available from: http://www.ncbi.nlm.nih.gov/pubmed/25389233.
12. Ercan A., Barnes M.G., Hazen M. et al. Multiple juvenile idiopathic arthritis subtypes demonstrate proinflammatory IgG glycosylation. Arthritis Rheum. 2012. № 64. Р. 3025-3033.
13. Fokkink W.J.R., Selman M.H.J., Dortland J.R. et al. IgG Fc N-glycosylation in Guillain-Barré syndrome treated with immunoglobulins. J. Proteome Res. 2014. № 13. Р. 1722-1730.
14. Selman M.H.J., Niks E.H., Titulaer M.J. et al. IgG fc N-glycosylation changes in Lambert-Eaton myasthenic syndrome and myasthenia gravis. J. Proteome Res. 2011. № 10. Р. 143-152. Avai-lable from: http://www.ncbi.nlm.nih.gov/pubmed/20672848.
15. Магорівська І.Б., Томін А.М., Думич Т.І. та ін. Спосіб оцінки параметрів молекул імуноглобуліну класу IgG у зразках сироватки крові. UA, UA: Патент України на корисну модель 95297. 2014. С. 1-6.
16. Kaneko Y., Nimmerjahn F., Ravetch J.V. Anti-inflammatory activity of immunoglobulin G resulting from Fc sialylation. Science. 2006. № 313. Р. 670-673. Available from: http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Citation&list_uids=16888140.
17. Магорівська І.Б., Білий Р.О., Муноз Л. та ін. Рівень сіалування антигістонових антитіл сироватки крові хворих на системний червоний вовчак. Біологічні студії. 2012. № 6. С. 55-64.
18. Paryzhak S., Dumych T., Mahorivska I. et al. Neutrophil-released enzymes can influence composition of circulating immune complexes in multiple sclerosis. Autoimmunity. 2018. № 51. Р. 297-303. Available from: https://www.tandfonline.com/doi/full/10.1080/08916934.2018.1514390.
19. Mo H., Winter H.C., Goldstein I.J. Purification and characterization of a Neu5Acalpha2-6Galbeta1-4Glc/GlcNAc-specific lectin from the fruiting body of the polypore mushroom Polyporus squamosus. J. Biol. Chem. 2000. № 275. Р. 10623-10629. Available from: http://www.jbc.org/content/275/14/10623.abstract.
20. Chen S., Lu C., Gu H. et al. Aleuria Aurantia Lectin (AAL)-Reactive Immunoglobulin G Rapidly Appears in Sera of Animals following Antigen Exposure. PLoS One. 2012. № 7.

/45.jpg)
/46.jpg)
/47.jpg)
/48.jpg)