Введение
Аневризматическое субарахноидальное кровоизлияние (САК) является распространенным и серьезным заболеванием, которое может иметь летальный исход [1]. Оно часто связано с высокой смертностью, заболеваемостью и является тяжелым бременем для здравоохранения [2]. Сообщалось, что на долю САК приходится 5 % всех инсультов; однако смертность от него составляет около 50 % (32–67 %). Только 30 % пациентов после САК могут вернуться к самостоятельной жизни [3]. Подсчитано, что частота САК составляет в среднем 10,5 на 100 000 человек в год, имея значительное колебание величин по различным регионам [4]. Клинические результаты САК зависят от множества факторов, таких как первичное кровоизлияние, повторное кровоизлияние, а также наличие или отсутствие отсроченной церебральной ишемии, наличие синдрома неадекватной секреции антидиуретического гормона (SIADH).
Гипонатриемия (ГН), которая определяется как концентрация натрия в сыворотке < 135 ммоль/л, является наиболее распространенным электролитным расстройством, встречающимся в клинических условиях, и считается частым осложнением после САК. Сообщается, что ГН встречается у 3–35 % тяжелых стационарных больных [5], в то время как у неврологических пациентов ГН может достигать 50 % [6]. ГН приводит к более высокой смертности, затратам на госпитализацию, к повышению частоты повторной госпитализации и более длительному пребыванию в больнице [7]. Синдром несоответствующей секреции антидиуретического гормона и синдром истощения солей головного мозга (CSWS) являются наиболее частыми причинами ГН у пациентов с неврологическими проблемами, в частности при САК [8]. Кроме того, SIADH и CSWS являются двумя типичными примерами рефрактерной ГН. SIADH провоцирует выраженную ГН, низкую осмоляльность сыворотки и повышенную осмоляльность натрия в моче. Возможно также возникновение серьезных нарушений, включающих мышечные спазмы, судороги и даже смерть на фоне тяжелой ГН [9]. Для постановки правильного диагноза SIADH требуется определение осмоляльности мочи и сыворотки, содержания натрия в моче, кортизола и гормонов щитовидной железы. Тем не менее недавний анализ реестра, включающего 1524 взрослых пациента с SIADH, которым был поставлен диагноз в 225 учреждениях в Соединенных Штатах и странах Европейского союза, показал, что надлежащие и всесторонние лабораторные исследования проводятся только у 21 % пациентов с SIADH. Кроме того, следующее исследование [10], выполненное под эгидой Итальянского эндокринного общества, показало, что менее половины опрошенных клиницистов смогли использовать подтвержденные биохимические параметры для диагностики SIADH. К тому же принципы лечения SIADH и схожих электролитных нарушений часто противоречат друг другу, что создает серьезные проблемы для врачей. Следовательно, клиническая дифференциация SIADH имеет важное значение.
Шкала комы Глазго (GCS), шкалы Hunt-Hess (HH) и Всемирной федерации нейрохирургических обществ (WFNS) являются широко используемыми клиническими классификациями, которые сосредоточивают внимание на признаках и симптомах, чтобы оценить степень тяжести состояния и прогноз; однако эти системы оценки не принимают во внимание объем и серьезность кровотечения. С развитием компьютерной томографии (КТ) некоторые радиографические шкалы получили дальнейшее развитие. Измеряя толщину и расположение субарахноидальной крови на КТ-снимке, шкала Fisher (FS) и модифицированная шкала Fisher (mFS) предсказывают частоту церебрального вазоспазма и отсроченной церебральной ишемии. Тем не менее необходимы дальнейшие исследования, чтобы определить точность и эффективность всех вышеуказанных шкал и методик. Несовершенство этих рентгенологических шкал приводит к недооценке важности клинических признаков пациентов. Таким образом, были предложены некоторые комбинированные системы оценок, такие как VASOGRADE (VG) и шкала HAIR, для прогнозирования исхода у пациентов с САК.
Актуальная задача данного исследования — создать новый показатель риска, соответствующий клиническим и рентгенологическим факторам, и сделать упор на изменениях в мозге в ранний период после САК (в течение 72 часов) для прогнозирования отсроченной церебральной ишемии. С учетом сложности и многофакторных аспектов прогресса в области исследования САК при стратификации рисков будет установлен новый показатель риска, который включает факторы риска в первые 72 часа. Эффективная система оценки может обеспечить раннее руководство по профилактике и лечению осложнений САК.
Связь работы с научными программами, планами, темами. Работа является фрагментом научно-исследовательской работы кафедры нервных болезней ГУ «Запорожская медицинская академия последипломного образования МЗ Украины»: «Комплексная диагностика и алгоритмы прогнозирования течения субарахноидального кровоизлияния у больных разных возрастных групп», № гос. регистрации 0115U000657.
Цель исследования: изучить динамику натриемии в контексте ее клинико-патогенетического значения у пациентов с субарахноидальным кровоизлиянием.
Материалы и методы
87 пациентов с САК принимали участие в клиническом исследовании, из них 38 человек (43,68 %) были с изолированным САК, 14 (16,09 %) — с субарахноидально-паренхиматозным, 29 (33,33 %) — с субарахноидально-желудочковым, 6 человек (6,9 %) — с субарахноидально-паренхиматозно-желудочковым кровоизлиянием, общее количество смешанных кровоизлияний — 56,32 %.
Все исследования выполнены с соблюдением основных положений «Правил этических принципов проведения научных медицинских исследований с участием человека», утвержденных Хельсинкской декларацией (1964–2013), ICH GCP (1996), Директивы ЕЭС № 609 (от 24.11.1986 г.), приказов МЗ Украины № 690 от 23.09.2009 г., № 944 от 14.12.2009 г., № 616 от 03.08.2012 г.
Наблюдалось следующее распределение по возрасту: большинство больных было в возрасте от 30 до 60 лет, больные в возрасте 40–60 лет преобладали по количеству, пациенты пожилого возраста (старше 60 лет) составили 20,7 %, средний возраст определялся на уровне 49,97 года. Мужчин в исследовании было 44, женщин — 43.
В результате разрыва мешотчатой аневризмы (МА) САК подтверждалось ангиографическим методом у 63 пациентов (72,41 %), у 5 из них произошло повторное кровоизлияние из разорвавшейся МА. Наличие МА или артериовенозной мальформации инструментально не подтвердилось в 27,59 % случаев, однако ангиографическое обследование этим пациентам проведено однократно. Чаще всего определялись аневризмы передней мозговой артерии и передней соединительной артерии ПМА-ПСА — 25,29 % случаев, внутренней сонной артерии — 14,94 % и средней мозговой артерии — 22,99 %, реже — аневризмы вертебробазилярного бассейна (2,3 %) и периферические аневризмы.
У 43 больных (49,43 %) в анамнезе отмечена артериальная гипертензия, у 5 больных определялись различные заболевания и синдромы поражения нервной системы, в основном дисциркуляторная энцефалопатия, судорожный синдром, САК в анамнезе. «Семейные» аневризмы выявлены у 2 больных.
Согласно классификации Всемирной организации нейрохирургов (WFNS), 33 пациента (37,93 %) имели легкую степень тяжести САК. У 37 человек (42,53 %) определена вторая степень тяжести — 13–14 баллов по шкале комы Глазго с отсутствием двигательного и речевого дефицита. К 3-й степени тяжести было отнесено 14 больных (16,09 %) — это 13–14 баллов по шкале комы Глазго и определенной степени выраженности двигательный и/или речевой дефицит. К 4-й степени тяжести были отнесены 2 пациента — 2,30 % с 7–12 баллами по шкале комы Глазго и наличием/отсутствием двигательного и/или речевого дефицита. Один больной (1,15 %) относился к категории крайней, 5-й степени тяжести с 3–6 баллами по шкале комы Глазго и наличием/отсутствием двигательного и/или речевого дефицита.
В соответствии со шкалой Нunt & Неss 31 пациент (35,63 %) с 1-й степенью тяжести не имел признаков САК или симптомы были с минимальным проявлением: головная боль и ригидность затылочных мышц. Ко 2-й степени тяжести было отнесено 38 человек (43,68 %) с симптомами в виде головной боли, ригидности затылочных мышц, отсутствием неврологического дефицита (кроме паралича черепных нервов). У 16 больных (18,39 %) диагностирована 3-я степень тяжести с сонливостью, оглушением или легким очаговым дефицитом. У 2 больных (2,30 %) определено тяжелое состояние и 4-я степень тяжести в виде ступора, умеренного или тяжелого гемипареза, ранней децеребрационной ригидности, вегетативных расстройств.
Согласно обобщающей классификационной шкале для оценки прогноза исхода САК (Ogilvy C.S. et Carter B.S.), 78–80% вероятность успешного исхода САК имели 76 больных с числом баллов от 0 до 2 (87,36 %). 10 больных (11,49 %) имели 3 балла и 65–67% вероятность успешного исхода. У одного больного (1,15 %) было 25 % согласно C.S. Ogilvy et B.S. Carter, неблагоприятный исход и суммарные 4 балла.
Было выполнено оперативное лечение у 40 больных (46 %), консервативная терапия применялась для 47 больных (54 %). Средняя продолжительность стационарного лечения составила 17,64 койко-дня.
Ангиографическое исследование проводили на ангиографическом комплексе AXIOM Artis MP «Siemens», селективно исследовали все сосудистые бассейны через феморальный доступ по методике Сельдингера.
Статистический анализ проводили с использованием пакетов прикладных программ Statistica 6.1 (StatSoft Inc., США, серийный номер RGXR412D674002FWC7), Microsoft Excel 2013. Для всех видов анализа статистически значимыми считали различия при р < 0,05.
С помощью критерия χ² с анализом таблиц сопряженности исследовали частоту встречаемости показателей. Для оценки ассоциации между переменными, выраженными в количественной шкале, проводили процедуру бинарного регрессионного анализа, используя линейную, логарифмическую, экспоненциальную, полиноминальную (2-я и 3-я степень) модели, достигая независимого (в соответствии с критерием Дарбина — Уотсона), нормального распределения остатков (согласно показателям асимметрии и эксцесса). Окончательный выбор уравнений регрессии проводили с помощью обобщенного критерия качества, который находили как взвешенную сумму обобщенного критерия точности и обобщенного критерия адекватности. В качестве критерия точности использовали нормированные значения средней относительной ошибки аппроксимации, а как критерий адекватности — нормированные значения критерия Дарбина — Уотсона. При анализе регрессионных уравнений принимали во внимание величину множественного коэффициента корреляции, а также величину коэффициента детерминации R2. Отдельные статистические процедуры и алгоритмы реализованы в виде специально написанных макросов в соответствующих программах.
Результаты
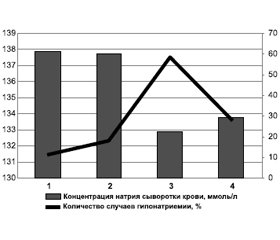
Гипонатриемия диагностирована у 4 человек с 1-й степенью тяжести САК по Fisher, сывороточный уровень натрия составлял в среднем 137,82 ± 0,75 ммоль/л, относительное количество случаев гипонатриемии от общей группы пациентов с данной степенью тяжести САК составило 11,76 % (рис. 1).
При 2-й степени тяжести согласно шкале Fisher у 4 пациентов диагностирована гипонатриемия со средним значением уровня натрия 137,73 ± 1,03 ммоль/л, 18,18 % пациентов от общего количества больных данной степени тяжести имели гипонатриемию.
В третьей группе больных гипонатриемия была обнаружена при среднем значении натрия сыворотки крови на уровне 132,82 ± 1,25 ммоль/л (р < 0,05) у 10 человек (58,82 %), относящихся к 3-й степени тяжести по шкале Fisher.
Согласно шкале Fisher, 4 больных (28,57 %) с наиболее тяжелым состоянием (самое массивное кровоизлияние — толстый слой САК с признаками внутрижелудочкового кровоизлияния (ВЖК) в двух боковых желудочках) имели низкий уровень натрия в сыворотке крови (р < 0,05), а средний показатель данного электролита в группе составлял 133,71 ± 1,16 ммоль/л.
Пациенты с САК 1-й (легкой) степени согласно WFNS имели уровень натрия сыворотки крови 138,94 ± 0,53 ммоль/л, а гипонатриемия у них не была выявлена (рис. 2).
В соответствии с классификацией WFNS у 15 пациентов со 2-й степенью тяжести заболевания (40,54 %) определены 13–14 баллов по шкале комы Глазго, отсутствие двигательного и речевого дефицита и гипонатриемия (р < 0,05). Среднее значение уровня натрия в этой группе было 135,49 ± 0,86 ммоль/л.
3–13 баллов по шкале комы Глазго, наличие/отсутствие двигательного и/или речевого дефицита, а также гипонатриемия (р < 0,05) диагностированы у 7 пациентов (41,18 %) с 3–5-й степенью тяжести САК по WFNS, средний уровень натрия составил 132,24 ± 1,21 ммоль/л.
Также уровень гипонатриемии имел тесную статистически достоверную связь с тяжестью клинического течения САК согласно шкале Нunt & Неss (рис. 3).
Согласно шкале Нunt & Неss, пациенты с 1-й степенью тяжести имели средний уровень натрия в сыворотке крови 138,67 ± 0,68 ммоль/л. 11 пациентов (26,19 %) со 2-й степенью тяжести, согласно шкале Нunt & Неss, имели гипонатриемию при среднем показателе сывороточного натрия по группе 136,83 ± ± 0,76 ммоль/л. При 3–4-й степени тяжести, согласно шкале Нunt & Неss, лабораторно диагностирован уровень натрия сыворотки крови 133,44 ± 1,03 ммоль/л, статистически достоверная гипонатриемия (р < 0,05) подтверждена у 11 пациентов этой группы (40,74 %).
Частота гипонатриемии у больных, согласно обобщающей классификационной шкале для оценки прогноза исхода САК (Ogilvy C.S. et Carter B.S.), представлена на рис. 4.
Минимальная степень тяжести САК 0 баллов согласно шкале Ogilvy соответствовала уровню натрия в сыворотке больных 138,83 ± 0,66 ммоль/л при отсутствии пациентов с гипонатриемией. 1 балл по шкале C.S. Ogilvy et B.S. Carter и гипонатриемию имели 6 больных (24,0 %), 2 балла и гипонатриемию (р < 0,05) демонстрировали 10 больных (35,71 %). 3–4 балла, согласно шкале Ogilvy, вместе с гипонатриемией имели 6 человек (54,55 %), в среднем по группе уровень натрия сыворотки крови составлял 131,73 ± 1,50 ммоль/л.
Частота выявления гипонатриемии у больных по шкале результатов GCS приведена на рис. 5.
Самые низкие средние значения уровня натрия крови пациентов с САК (128,67 ± 3,67 ммоль/л) обнаружены у больных с угнетенным сознанием и оценкой менее 13 баллов по шкале комы Глазго, у 2 (66,66 %) пациентов этой когорты обнаружена гипонатриемия. Уровень натрия 133,33 ± 1,58 ммоль/л и 134,8 ± 0,78 ммоль/л соответствует умеренному угнетению сознания пациентов с САК и 13–14 баллам по шкале комы Глазго (р < 0,05). У 50,0 % пациентов с 13 баллами диагностирована гипонатриемия (3 пациента) (р < 0,05). Уровень сознания в 14 баллов по шкале комы Глазго у 16 больных ассоциирован с гипонатриемией (36,36 %) (р < 0,05). Пациенты с ясным сознанием и 15 баллами по шкале комы Глазго имели следующий сывороточный уровень натрия — 139,09 ± 0,53 ммоль/л, у одного пациента зафиксирована статистически достоверная (р < 0,05) гипонатриемия (2,94 %).
Для исследования направленности, тесноты и характера связи между показателями и для построения функциональной зависимости между исследуемыми переменными был проведен бинарный регрессионный анализ, в ходе которого в качестве независимого аргумента рассматривали уровень экспрессии копептина (биомаркера звена системы нейрогормональной регуляции), а в качестве зависимой переменной — уровень натриемии. Взаимосвязь между числовыми переменными у пациентов с нормальным уровнем натрия в сыворотке крови носила недостоверный характер, а у лиц с гипонатриемией полученное соотношение с высокой степенью точности и адекватности аппроксимировалось моделью логарифмического характера: Na = 124,19 – 29,9 • log10 (Copeptin), где R = 0,83, R2 = 0,69, нормированный R2 = 0,66 при F = 42,14, p < 0,001.
Была обнаружена достоверная тесная взаимосвязь между уровнем данного пептида с нейроэндокринными свойствами — копептина и нарушением осмотического гомеостаза, причем эта модель описывает около 69,8 % дисперсии признака натриемии.
Сопряженность сывороточного уровня натрия и показателя сывороточного копептина адекватно и достоверно аппроксимируется уравнением регрессии логарифмического характера (по основанию 10), при значениях независимого предиктора более 0,70 нг/мл в более чем 50 % случаев регистрировалась натриемия средней степени тяжести.
Обсуждение
SIADH впервые был описан Schwartz et al. у пациентов с бронхогенной карциномой легкого в 1957 году, характеризовался ГН, высокой осмоляльностью и концентрированностью мочи в отсутствие других причин ГН. ГН, вторичная по отношению к SIADH, является результатом задержки воды из-за нарушения регуляции высвобождения антидиуретического гормона или мутаций, связанных с усилением функции в рецепторе вазопрессина V2 в почечных собирательных канальцах. Критерии, постулированные Misra et al. [11] для диагностики SIADH, и по крайней мере две из четырех следующих характеристик необходимы пациенту с ГН для подтверждения SIADH:
— отсутствие признаков гиповолемии, таких как гипотензия, сухость слизистой оболочки, тахикардия или постуральная гипотензия;
— нет лабораторных доказательств дегидратации, таких как повышенный гематокрит, гемоглобин, сывороточный альбумин или мочевина крови;
— нормальный или положительный баланс жидкости при отсутствии потери веса;
— центральное венозное давление (ЦВД) > 6 см.
САК, черепно-мозговая травма, инсульт, опухоли головного мозга, инфекции ЦНС и синдром Гийена — Барре классифицируются как распространенные неврологические расстройства с высокой частотой клинических проявлений ГН [12].
В большинстве исследований SIADH был классифицирован как наиболее частая причина тяжелой гипонатриемии среди пациентов с САК [13]. При SIADH избыточная секреция антидиуретического гормона вызывается стимуляцией гипоталамуса различными травмирующими или ишемическими факторами, что приводит к усилению реабсорбции воды в дистальных извитых канальцах почки, вызывая задержку жидкости и дилюционную гипонатриемию. Тем не менее этиология гипонатриемии после САК разнообразна. В дополнение к SIADH CSWS, острая недостаточность кортизола, чрезмерная внутривенная терапия, диуретическая терапия или комбинация этих факторов могут способствовать усилению натрийуреза. Надлежащая терапия должна быть нацелена на правильную этиологию гипонатриемии, чтобы быть эффективной в снижении заболеваемости или смертности, связанной с гипонатриемией, у пациентов с САК.
При CSWS секреция антидиуретического гормона в плазме нормальная, но характеризуется экскрецией натрия с мочой, а также сокращением внеклеточной жидкости и объема циркулирующей крови, вызывая гипонатриемию. CSWS является причиной гипонатриемии только в меньшинстве случаев. Као и соавт. сообщили, что 34,5 % случаев тяжелой гипонатриемии были вызваны SIADH, а 23 % — CSWS [14]. Следует отметить, что пациенты, включенные в это исследование, имели более тяжелую степень САК, чем в сравнительных исследованиях, и критерием включения был уровень Na < 130 мэкв/л в плазме.
Хотя имеется целый ряд дискуссионных вопросов относительно частоты различной этиологии гипонатриемии при САК, SIADH четко определена как наиболее распространенная причина гипонатриемии после САК. У пациентов с CSWS патологическое выделение натрийуретических гормонов может способствовать чрезмерному натрийурезу. Множественные нарушения, встречающиеся в комбинации, включая увеличение секреции натрийуретического пептида, ингибирование ренин-альдостероновой системы и чрезмерную адренергическую активность, могут способствовать гипонатриемии.
Предыдущие исследования показали, что у 40–57 % пациентов, поступивших с САК, может развиться ГН, особенно у пациентов, у которых была диагностирована высокая степень тяжести САК, при наличии аневризм передней циркуляции и гидроцефалии [15]. По оценкам, у 40 % пациентов может развиться ГН в течение первых 3 дней кровоизлияния, в то время как у около 30 % пациентов ГН развивается через 1 неделю после разрыва [16], что свидетельствует о том, как важно контролировать изменения натрия в сыворотке крови в течение первой недели после САК. Патологические механизмы, лежащие в основе САК-ассоциированной ГН, в настоящее время не ясны. Существуют разные мнения об этиологии ГН после САК, некоторые исследования в небольших группах пациентов показали, что CSWS является наиболее частой причиной возникновения ГН после САК. В конечном счете, гораздо большее количество исследований продемонстрировали, что большинство случаев ГН после САК обусловлены SIADH. Предыдущее исследование [17] указывало, что гаптоглобин, белок острой фазы, основной функцией которого является связывание свободного гемоглобина, является независимым предиктором ГН после САК. Частота возникновения ГН у пациентов не зависела от того, кому выполнялась интервенционная радиологическая методика лечения аневризм или краниотомия с клиппированием. Ретроспективный анализ 335 пациентов, проведенный Hoffman et al. [18], привел к предположению, что SIADH чаще встречается, нежели CSWS, при аневризмах передней мозговой артерии (90 %) по сравнению с аневризмами задней мозговой артерии (75 %). Кроме того, более тяжелое клиническое течение САК у пациентов, согласно шкале Hunt-Hess, было связано с развитием SIADH.
Рекомендуется ограничение жидкости для лечения ГН при неосложненном SIADH [19]; однако это может усугубить поражение головного мозга у пациента с осложненной ГН, вызванной САК. В отсутствие точно установленной причины ГН ограничение жидкости может привести к цереброваскулярному истощению и спазму сосудов головного мозга, что указывает на то, что ограничение жидкости не является безопасным и выполнимым методом дифференциации трудноизлечимой ГН. Кроме того, введение изотонического солевого раствора не всегда эффективно для повышения уровня натрия в сыворотке крови при SIADH, в то время как эта процедура может восстанавливать пониженные уровни натрия в сыворотке и внутрисосудистый объем у большинства пациентов с CSWS. Таким образом, кратковременная инфузия изотонического солевого раствора, который, как ожидается, нормализует содержание натрия в сыворотке крови, но не в случае с SIADH, может служить методом идентификации данного синдрома. Однако одной изотонической жидкости часто недостаточно для лечения CSWS; обычно необходимо использовать гипертонический солевой раствор, а иногда, в некоторых рефрактерных случаях, следует использовать флудрокортизон.
Толваптан, пероральный антагонист вазопрессиновых V2-рецепторов, может быть привлекательным вариантом для коррекции ГН из-за SIADH. Испытания SALT-1 и SALT-2 показали, что показатель сывороточного натрия можно безопасно улучшить на 4-й и 30-й день путем введения толваптана у пациентов с SIADH [20]. Роль толваптана в лечении SIADH бесспорна, однако стоимость терапии и необходимость долгосрочных данных о безопасности может ограничить его широкое использование. Кроме того, важно внимательно следить за содержанием натрия в сыворотке крови (рекомендуется каждые 4–6 ч после начала лечения) в случае чрезмерно быстрой коррекции, введение болюса солевого раствора полезно перед ограничением жидкости или испытанием с толваптаном.
Выводы
Исследование SIADH-синдрома с развитием гипонатриемии у стационарных пациентов с САК нетравматического генеза свидетельствует о тесной ассоциации между выраженностью нарушений осмотического гомеостаза и тяжестью клинического течения САК согласно модифицированной шкале Fisher, шкале WFNS, шкале Нunt & Неss, шкале комы Глазго и обобщающей классификационной шкале для оценки прогноза исхода САК (Ogilvy C.S. et Carter B.S.). У лиц с гипонатриемией на фоне САК сопряженность сывороточного уровня натрия и показателя сывороточного уровня копептина адекватно и достоверно аппроксимируется уравнением регрессии логарифмического характера (по основанию 10), при значениях копептина более 0,70 нг/мл в более чем 50 % случаев регистрировалась натриемия средней степени тяжести.
Перспективой дальнейших исследований является определение динамики натриемии у больных с САК на фоне лечения.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов и собственной финансовой заинтересованности при подготовке данной статьи.
Список литературы
1. Lummel N., Bernau C., Thon N. et al. Prevalence of superficial siderosis following singular, acute aneurysmal subarachnoid hemorrhage. Neuroradiology. 2015. Vol. 57. P. 349-56.
2. Kundra S., Mahendru V., Gupta V. et al. Principles of neuroanesthesia in aneurysmal subarachnoid hemorrhage. J. Anaesthesiol. Clin. Pharmacol. 2014. Vol. 30. P. 328-37.
3. Macdonald R.L. Delayed neurological deterioration after subarachnoid haemorrhage. Nat. Rev. Neurol. 2014. Vol. 10. P. 44-58.
4. Naraoka M., Matsuda N., Shimamura N. et al. Long-acting statin for aneurysmal subarachnoid hemorrhage: a randomized, double-blind, placebo-controlled trial. J. Cereb. Blood Flow Metab. 2018. Vol. 38. P. 1190-8.
5. Gang X., Zhang Y., Pan X., Guo W., Li Z., Wang Y., Wang G. Hyponatremia: Prevalence and characteristics in internal medicine patients in southeast of China. Medicine (Baltimore). 2018. Vol. 97 (49). P. 133-89.
6. Rahman M., Friedman W.A. Hyponatremia in neurosurgical patients: clinical guidelines development. Neurosurgery. 2009. Vol. 65 (5). P. 925-35.
7. Althaus A.E., Krapf R. Quality and cost considerations in hyponatraemic patients needing hospitalisation. Swiss. Med. Wkly. 2018. Vol. 10 (148). P. 146-62.
8. Moritz M.L. Syndrome of Inappropriate Antidiuresis. Pediatr. Clin. North Am. 2019. Vol. 66 (1). P. 209-226.
9. Mönig H., Arlt A. Hyponatremia: Differential Diagnosis and Treatment. Dtsch. Med. Wochenschr. 2017. Vol. 142 (16). P. 1231-1247.
10. Giuliani C., Cangioli M., Beck-Peccoz P. Awareness and management of hyponatraemia: the Italian Hyponatraemia Survey. J. Endocrinol. Invest. 2013. Vol. 36 (9). P. 693-8.
11. Misra U.K., Kalita J., Bhoi S.K., Singh R.K. A study of hyponatremia in tuberculous meningitis. J. Neurol. Sci. 2016. Vol. 15 (367). P. 152-7.
12. Rumalla K., Reddy A.Y., Letchuman V., Mittal M.K. Hyponatremia in Guillain-Barré Syndrome. J. Clin. Neuromuscul. Dis. 2017. Vol. 18 (4). P. 207-217.
13. Verbalis J.G. Hyponatremia with intracranial disease: Not often cerebral salt wasting. J. Clin. Endocrinol. Metab. 2014. Vol. 99. P. 59-62. doi: 10.1210/jc.2013-4289.
14. Kao L., Al-Lawati Z., Vavao J., Steinberg G.K., Katznelson L. Prevalence and clinical demographics of cerebral salt wasting in patients with aneurysmal subarachnoid hemorrhage. Pituitary. 2009. Vol. 12. P. 347-351. doi: 10.1007/s11102-009-0188-9.
15. Hannon M.J., Behan L.A., O'Brien M.M. Hyponatremia following mild/moderate subarachnoid hemorrhage is due to SIAD and glucocorticoid deficiency and not cerebral salt wasting. J. Clin. Endocrinol. Metab. 2014. Vol. 99 (1). P. 291-8.
16. Sherlock M., O'Sullivan E., Agha A. The incidence and pathophysiology of hyponatraemia after subarachnoid haemorrhage. Clin. Endocrinol. (Oxf). 2006. Vol. 64 (3). P. 250-4.
17. Murthy S.B., Caplan J., Levy A.P. Haptoglobin 2-2 Genotype Is Associated With Cerebral Salt Wasting Syndrome in Aneurysmal Subarachnoid Hemorrhage. Neurosurgery. 2016. Vol. 78 (1). P. 71-6.
18. Hoffman H., Ziechmann R., Gould G., Chin L.S. The Impact of Aneurysm Location on Incidence and Etiology of Hyponatremia Following Subarachnoid Hemorrhage. World Neurosurg. 2018. Vol. 110. P. 621-6.
19. Spasovski G., Vanholder R., Allolio B. Clinical practice guideline on diagnosis and treatment of hyponatraemia. Nephrol. Dial. Transplant. 2014. Vol. 2. P. 1-39.
20. Cuesta M., Thompson C.J. The syndrome of inappropriate antidiuresis (SIAD). Best Pract. Res. Clin. Endocrinol. Metab. 2016. Vol. 30 (2). P. 175-87.
/85.jpg)

/86.jpg)